

相关实验
实验承诺函
咨询记录
技术文章

城市
时间
内蒙古自治区呼和浩特市
2026-02-21 11:28:50
浙江省杭州市
2026-02-21 06:00:07
广东省东莞市
2026-02-21 00:10:44
广东省东莞市
2026-02-21 00:10:44
广东省东莞市
2026-02-20 09:11:41
内蒙古自治区呼和浩特市
2026-02-19 12:12:09
内蒙古自治区呼和浩特市
2026-02-17 11:47:06
山东省济南市
2026-02-17 00:24:08
内蒙古自治区呼和浩特市
2026-02-16 04:49:44
河北省沧州市肃宁县
2026-02-16 03:51:16
实验介绍
【应用简介】
迁移是肿瘤细胞转移过程中必不可少的环节之一。肿瘤细胞与母体瘤分离,穿越血管壁,侵袭周边正常组织时,需要一定的运动能力。高转移的肿瘤细胞通常具奋较强的运动性。多种物质可剌激肿瘤细胞的迁移,如肿瘤细胞分泌因子、生长因子、细胞外基质成分(FN、LN)以及一些癌转移靶器官的代谢产物或分泌产物等生长因子对肿瘤细胞有趋化作用,可使其发生定向运动。测定方法以细胞划痕法和Transwell小室法。
【技术原理】
细胞划痕法是简捷测定细胞迁移运动与修复能力的方法,类似体外伤口愈合模型,在体外培养皿或平板培养的单层贴壁细胞上,用微量枪头或其他硬物在细胞生长的中央区域划线,去除中央部分的细胞,然后继续培养细胞至实验设定的时间,取出细胞培养板,观察周边细胞是否生长至中央划痕区,以此判断细胞的生长迁移能力,实验通常需设定正常对照组和实验组,实验组是加了某种处理因素或药物、外源性基因等的组别,通过不同分组之间的细胞对于划痕区的修复能力,可以判断各组细胞的迁移与修复能力。
【实验方法】
Step1:细胞培养
Step2:细胞接种于6孔板中
Step3:细胞转染或药物处理
Step4:划痕
Step5:镜检
案例展示
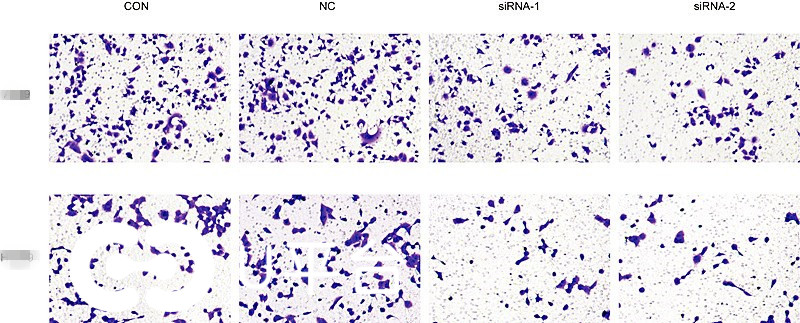
2株肺癌细胞的Transwell侵袭能力检测
技术总结
1、细胞划痕实验选择6孔板进行。
2、使用培养板前,应事先在孔板背部用马克笔画上数条穿过孔板的平行横线,便于之后的拍照定位。
3、细胞接种如6孔板时,密度应选择能使其在第二天融合度达到90%以上为宜。
4、对细胞层进行划痕时,用枪头比着直尺,尽量垂直于背后的横线划痕,枪头要垂直,不能倾斜(不同孔之间最好使用同一只枪头)。
5、划痕后,PBS洗细胞3次,去除划下的细胞,使划痕区域干净,再加入无血清培养基。
6、按时间点4倍镜下进行拍照,保证划痕居中且垂直,注意背景一致。
送检与交付标准
| 样品类型 | 样品需求 | 保存条件 | 运输条件 | 备注 |
|---|---|---|---|---|
| 冻存细胞 | 1.取对数生长期的细胞,消化离心收集细胞,加入冻存液吹打混匀,装入冻存管,标明细胞名称/细胞代数,冻存细胞数量在1-5*106个/ml。 2.项目启动后细胞复苏,复苏后3天反馈细胞状态,3-5天反馈细胞污染情况,5-7天反馈支原体污染情况。 3. 细胞详细信息(名称、培养基和其他培养条件等,如经过特别处理需告知并提供必要的信息) | 液氮 | 干冰 | 所有样本均须有唯一标记,且标记清晰可识 |
| 复苏后细胞 | 1.使用T25培养瓶运输。细胞汇合度达到60%以上,装满培养液,只留纽扣大小的气泡,瓶口用封口膜封好,标明细胞名称/细胞代数/接种时间/培养基类型,瓶子固定运输。 2.收到细胞后3天反馈细胞状态,3-5天反馈细胞污染情况,5-7天反馈支原体污染情况。 3. 细胞详细信息(名称、培养基和其他培养条件等,如经过特别处理需告知并提供必要的信息) | 常温 | 常温 | |
| 质粒 | 1.纯度高,无内毒素,无蛋白质,基因组DNA/RNA污染,质粒A260:A280的比值在1.8-2.0之间 2.浓度不低于0.5μg/μl,总量大于100μg,无内毒素处理 3. 载体详细信息,包括名称、大小、抗性、荧光标记 | -20℃ | 冰袋 | |
| 病毒 | 1.慢病毒:滴度不低于1*108TU/ml,体积约200μl,标明制备时间,且没有反复冻融 2.腺病毒:滴度不低于1*109PFU/ml,体积约200μl,标明制备时间,且没有反复冻融 3.明确是否表达荧光标签蛋白及其种类,最好需要提供病毒载体图谱; | -80℃ | 干冰 |

