

EdU细胞增殖检测标准化操作流程流式+荧光双平台兼容
 2025-06-24 18:09:57
2025-06-24 18:09:57
来源/作者:普拉特泽-生物医学整体课题外包平台
本文就给小白们从简介原理分类方法细细讲讲,梳理夯实一下基础。让大家充分掌握EdU细胞增殖检测标准化操作流程!
普拉特泽生物本篇详解了流式细胞术与荧光显微镜双平台兼容方案,涵盖原理、试剂、详细步骤、关键注意事项及结果分析,助力获得准确可重复的细胞增殖数据。适用于肿瘤、干细胞、药物筛选等研究。
简介:
EdU(5-乙炔基-2'-脱氧尿苷)检测法因其操作简便、灵敏度高、无需变性DNA、与多种检测平台兼容(尤其是流式细胞术和荧光显微镜)等优势,已成为BrdU的理想替代方案。实现流式细胞术(定量分析细胞群体)与荧光显微镜(提供形态学定位信息)双平台的兼容性,能更全面、深入地解读细胞增殖状态。
本标准化操作流程旨在提供一套清晰、可靠且经过优化的实验方案。
(一) 实验目的
准确检测和定量分析体外培养细胞的增殖活性。
实现同一批EdU标记样本可同时用于流式细胞术(定量)和荧光显微镜(定性/半定量及形态学观察)分析。
建立标准化流程,确保实验结果的可重复性和可比性。
(二)实验原理
EdU是一种胸腺嘧啶核苷类似物。在细胞增殖的S期,EdU能掺入新合成的DNA链中。随后,通过高效的“点击化学”反应(通常基于Cu(I)催化或更温和的无铜催化体系),EdU分子上的乙炔基与连接有荧光染料(如Alexa Fluor 488, 594, 647等)的叠氮化物共价结合。
这种特异性的结合使得掺入了EdU的DNA被荧光标记,从而可在流式细胞仪上定量分析增殖细胞比例
或在荧光显微镜下直观观察增殖细胞的分布与形态。
(三) 实验材料与试剂
细胞: 待测细胞系或原代细胞。
培养基: 细胞相应的完全培养基。
▲EdU工作液: 推荐使用商品化的EdU试剂盒(如Click-iT™ Plus EdU系列)。通常需用预热的不含血清培养基或PBS配制合适浓度(常用终浓度10-50 μM,需预实验优化)。
▲固定液: 含3-4%多聚甲醛的PBS(新鲜配制或使用商品化固定液)。兼容关键: 适用于双平台。
▲透化/封闭液: 含0.5-1% Triton X-100(或Saponin)和1-3% BSA(或合适血清)的PBS。兼容关键: 适用于双平台。
▲点击化学反应缓冲液: 核心兼容试剂! 必须选择试剂盒中明确标明同时兼容流式细胞术和免疫荧光(IF/IHC) 的组分。包含:
CuSO₄溶液 (如适用)
●荧光染料叠氮化物 (如Alexa Fluor® 488 Azide, AF594 Azide, AF647 Azide - 根据平台和仪器通道选择)
●缓冲液添加剂/反应缓冲液 (确保流式信号强度与显微背景可控)
●点击反应催化剂/加速剂 (如用于无铜催化的试剂)
●DAPI或Hoechst 33342: 细胞核复染剂(用于荧光显微镜定位)。
流式染色缓冲液: 含1% BSA的PBS(用于流式样本重悬)。
耗材: 细胞培养板/皿、离心管、移液器及吸头、冰盒、计时器、封口膜/Parafilm。
仪器:
①流式细胞仪 (配备相应激光器和滤光片以检测所选荧光染料)
②荧光显微镜 (配备相应激发/发射滤光块以检测所选荧光染料和核染料)
(四) 标准化操作流程 (双平台兼容核心)
细胞铺板与培养:
将处于对数生长期的细胞以合适密度接种于培养板(用于显微镜观察,如玻底培养皿或爬片)或培养皿(用于流式收集)中。确保实验组和对照组设置合理。
在37°C, 5% CO₂培养箱中培养过夜或至细胞达到约60-80%汇合度(具体密度需优化)。
EdU标记:
吸弃旧培养基。
⒈加入预热的EdU工作液: 用预热(37°C)的无血清培养基或PBS稀释商品化EdU储备液至所需终浓度(务必进行浓度梯度预实验优化)。轻柔加入覆盖细胞。
孵育: 将细胞放回培养箱,孵育适当时间(通常1-4小时,取决于细胞周期长短和研究目的,需优化)精确计时。
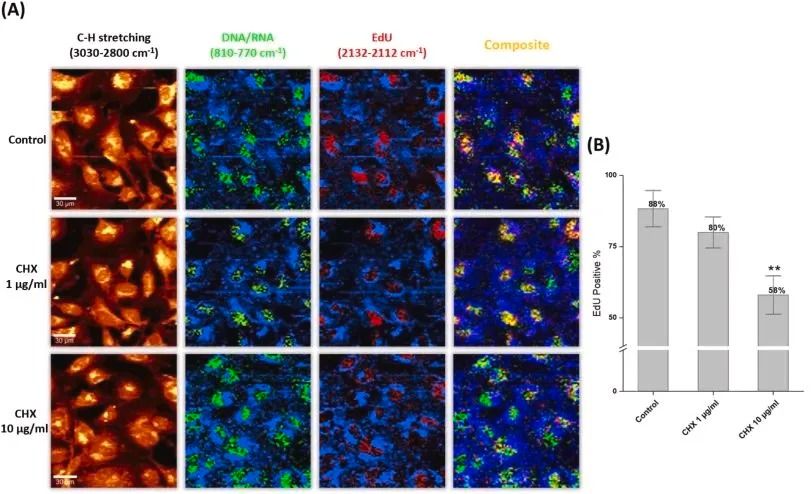
终止标记与清洗:
小心吸弃含EdU的培养液。
快速清洗: 用预热的完全培养基(含血清)或PBS轻柔洗涤细胞2-3次,每次1-2分钟,以终止标记并去除未掺入的EdU。动作需轻柔,避免细胞脱落(尤其流式样本)。
细胞固定:
吸弃清洗液。
ⅰ加入固定液: 加入足量(完全覆盖细胞)预冷的3-4%多聚甲醛/PBS。
ⅱ室温固定: 在室温下避光固定15-30分钟(避免过度固定)。
ⅲ清洗: 吸弃固定液,用PBS轻柔洗涤细胞3次,每次5分钟。可于4°C PBS中保存数天(避光),但建议尽快进行后续步骤。
细胞透化与封闭:
吸弃PBS。
⑴加入透化/封闭液: 加入足量含0.5-1% Triton X-100 (或Saponin) 和1-3% BSA (或血清)的PBS。
⑵室温孵育: 避光孵育30-60分钟。此步骤使试剂穿透细胞膜/核膜,并封闭非特异性结合位点,对降低背景至关重要,尤其显微镜观察。
点击化学反应 (核心步骤 - 兼容性关键):
吸弃透化/封闭液。
配制点击反应混合液: 严格按照所选兼容试剂盒的说明书进行配制! 通常按比例混合:
缓冲液
CuSO₄溶液 (如使用铜催化体系)
荧光染料叠氮化物 (选择合适颜色,如AF488用于绿色通道/FITC通道,AF594用于红色通道/PE通道,AF647用于远红通道/APC通道)
反应加速剂/催化剂 (如含硫配体的溶液用于铜催化,或专用无铜催化剂)
确保混合液充分混匀且现配现用
①加入反应液: 将配制好的点击反应混合液轻柔加入细胞中,确保完全覆盖。
②避光孵育: 室温下避光孵育30分钟(具体时间参照试剂盒说明,无铜体系可能需更长时间)。严格控制反应时间。
清洗:
吸弃点击反应液。
③彻底清洗: 用含1% BSA的PBS(或试剂盒推荐的洗涤缓冲液)轻柔洗涤细胞3-4次,每次5-10分钟,充分去除未反应的荧光染料和试剂,这是降低背景的关键步骤
用含 1% BSA 的 PBS(或试剂盒推荐的专用洗涤缓冲液)轻柔洗涤细胞 3-4 次,每次 5-10 分钟,以充分去除未反应的荧光染料及残留试剂,该步骤是降低非特异性背景的关键
对荧光显微镜观察尤为重要,可在最后一次清洗液中加入DAPI (1 μg/mL) 进行核染(用于显微镜样本)。
样本分流与平台特异性处理:
流式细胞术样本:
对于贴壁细胞(如培养皿中):用胰酶(不含EDTA或含低浓度EDTA)或细胞刮刀小心消化/刮下细胞。转移至流式管。
对于悬浮细胞:直接收集至流式管。
⑴用预冷的流式染色缓冲液(含1% BSA的PBS)重悬细胞,300-500g离心5分钟,弃上清。
⑵用适量(如300-500 μL)流式染色缓冲液重悬细胞,过细胞筛(如40μm尼龙网)。
⑶立即上机分析或4°C避光保存(通常不超过24小时)。
荧光显微镜样本:
对于培养板/玻底皿中的细胞:吸弃最后一次清洗液(或含DAPI的清洗液)。
封片: 加入少量抗淬灭封片剂(如ProLong® Gold, Vectashield®),小心盖上盖玻片,避免气泡。封口膜封边。
避光保存: 4°C避光保存,尽快观察(数天内)。
(五)、 数据采集与分析
流式细胞术:
⒈设置流式细胞仪:使用未标记EdU的平行处理样本(阴性对照)调节电压和补偿。
⒉获取数据:收集足够数量的事件(通常>10,000个细胞)。
⒊分析:圈定目标细胞群(如FSC/SSC门排除碎片和死细胞),在EdU荧光通道(如FITC对应AF488)设门。计算EdU阳性细胞百分比、平均荧光强度(MFI)等。可结合DNA染料(如7-AAD, DAPI)分析细胞周期(需在透化步骤后额外染色)。
荧光显微镜:
使用配备相应滤光块的荧光显微镜观察。
EdU信号: 观察特定荧光通道下的阳性信号(明亮的点状或弥散核内信号)。
细胞核: 观察DAPI/Hoechst通道下的蓝色核染色。
分析:可定性观察增殖细胞的分布模式(如特定区域富集)、细胞形态(如分裂期形态)。可进行半定量分析,如在不同视野计数EdU阳性细胞数占总细胞数的比例(需保证细胞密度和视野选择的一致性),或使用图像分析软件进行定量。

(六)、关键注意事项与优化点 (标准化核心)
①EdU浓度与孵育时间: 必须预实验优化! 浓度过高或时间过长可能导致非S期细胞背景染色或细胞毒性;过低或过短则信号弱。参考细胞周期时间。
②点击化学试剂盒选择: 务必选择明确标注“兼容流式细胞术和免疫荧光/免疫组化”的试剂盒。 不同平台对反应效率、背景控制要求不同。无铜催化体系通常背景更低,对细胞形态影响更小,更推荐用于显微镜,但部分也兼容流式。
③荧光染料选择: 根据流式细胞仪激光器和滤光片配置以及显微镜滤光块选择合适波长的叠氮染料。确保与仪器兼容且避免光谱重叠。常用AF488(绿), AF594(红), AF647(远红)。
→固定: 使用新鲜配制的多聚甲醛,避免过度固定导致抗原表位遮蔽或自发荧光增加。
→透化: Triton X-100浓度和孵育时间需优化。浓度过高或时间过长可能破坏细胞结构(尤其显微镜样本);不足则试剂无法进入。Saponin可逆性透化对某些抗原保存更好。
→封闭: 充分的封闭(BSA或血清)对降低非特异性背景至关重要,尤其在显微镜下观察时。
→点击反应: 严格按试剂盒说明配制反应液,确保各组分比例准确。反应时间需精确控制。
→清洗: 彻底清洗是降低背景的关键! 特别是点击反应后和显微镜样本封片前。
〖1〗对照设置: 必不可少!
〖2〗阴性对照: 不添加EdU,但进行后续所有步骤(包括点击反应)。用于设门(流式)和确定背景水平(显微镜)。
〖3〗阳性对照: 已知高增殖率的细胞(如活化的淋巴细胞)。
〖4〗单染对照: 如果进行多色分析(如EdU+细胞周期染料),需要单染样本调节补偿。
〖5〗细胞状态: 确保细胞处于良好状态,避免过度融合或营养不良影响增殖。
〖6〗避光操作: 从EdU标记开始,所有涉及荧光染料的步骤均需避光操作,防止荧光淬灭。
〖7〗平行处理: 用于双平台分析的样本应在同一批次实验中用完全相同的试剂和条件进行处理,以保证结果的可比性。
(七)、结果判读与报告
清晰报告EdU标记浓度、孵育时间、使用的具体试剂盒型号(尤其是点击化学部分)、点击反应所用荧光染料、分析平台(流式型号、显微镜型号及物镜倍数)。
▲流式结果: 提供代表性流式图(FSC/SSC, EdU vs. 其他参数如DNA含量)、EdU阳性细胞百分比、MFI、统计学分析结果。
▲显微镜结果: 提供代表性荧光图片(需包含EdU通道、核通道、Merge图),标注比例尺。描述增殖细胞分布特征。如有半定量数据,报告计数方法及结果。
▲双平台关联: 结合流式定量数据和显微镜形态学/定位信息,对细胞增殖状态进行更全面的解读。例如,流式显示某药物处理组增殖率下降,显微镜可进一步观察是均匀抑制还是特定亚群受影响,或细胞是否呈现凋亡/坏死形态。
好啦,EdU细胞增殖检测标准化操作流程我们就简单介绍到这里啦,同学们有没有一个简单的了解呢?不懂得可以给客服留言技术给您详细解答。下一篇再详细为大家介绍药物筛选高通量方案:EdU-CCK8双轨验证细胞活性与增殖,普拉特泽生物誓让大家透彻EdU细胞增殖实验的检测过程。
当然您有EdU细胞增殖或其他医学科研实验外包的需求,欢迎随时咨询

