

10μM EdU孵育2小时:贴壁与悬浮细胞最佳处理方案指南
 2025-06-26 12:17:44
2025-06-26 12:17:44
来源/作者:普拉特泽-生物医学整体课题外包平台
细胞增殖研究的精度往往隐藏在实验细节中。EdU检测技术革新了传统方法,而10μM浓度下2小时的孵育时间正是大多数哺乳动物细胞平衡标记效率与细胞活性的黄金节点。
本篇由普拉特泽生物细胞检测平台总结分享,细胞检测平台为广大科研实验人员提供EDU检测细胞增殖外包实验服务,先一起来学习学习什么是细胞实验吧。
细胞增殖检测是评估细胞活性、代谢状态及生理病理变化的核心手段。EdU(5-乙炔基-2’-脱氧尿苷)检测技术作为BrdU方法的升级换代方案,通过点击化学反应实现DNA合成期细胞的高效标记。
与传统BrdU法相比,EdU技术无需DNA变性处理,避免了剧烈的酸解、热解或酶解操作。这一特性不仅保护了细胞形态和DNA结构的完整性,还保留了细胞内抗原识别位点,为多重实验设计提供了便利。
10μM EdU孵育2小时已成为HeLa、3T3、HEK293等常见哺乳动物细胞系的标准方案,其科学依据在于:大多数哺乳动物细胞周期约为18-25小时
而2小时孵育恰好占其细胞周期的约10%,既能有效标记S期细胞,又最大限度减少了对细胞正常代谢的干扰
——01 EdU检测的核心优势与原理
EdU检测的核心优势在于其独特的“点击化学”(Click Chemistry)反应机制。EdU作为胸苷类似物,在DNA合成期主动掺入新合成的DNA链中。其分子末端的乙炔基团可与荧光标记的叠氮化物(如Azide 488、Azide 594)在一价铜离子催化下形成稳定的三唑环,实现共价结合。
这一反应具有三大独特优势:
▲反应迅速高效:30分钟内即可完成,大幅缩短实验时间
▲无需DNA变性:避免传统BrdU法所需的严苛变性处理(HCl或酶解)
▲小分子探针:分子量仅为BrdU抗体的1/5
这些特性使EdU技术特别适合多重标记实验设计。研究人员可同时进行细胞核染色(如Hoechst 33342)、免疫荧光检测(如P65抗体)以及细胞周期蛋白标记,在单细胞水平获取多维信息。
不同细胞类型对EdU的掺入效率存在显著差异。下表总结了各类细胞的推荐处理参数:
表:不同细胞类型的EdU处理参数参考
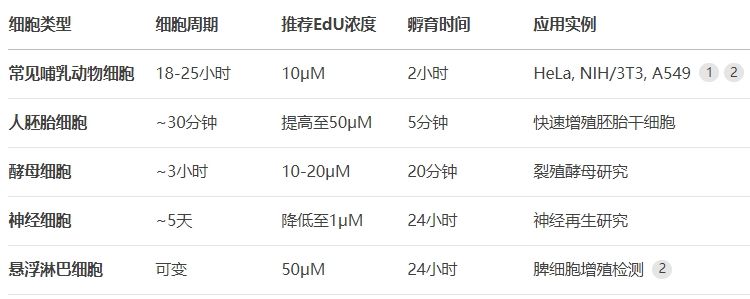
实验设计时需注意:初次使用应进行浓度梯度测试。若实验室有BrdU使用经验,可参考原有BrdU浓度作为EdU起始浓度。
——02 贴壁细胞EdU处理标准化方案
贴壁细胞作为实验室最常用的模型系统,其EdU标记需精细控制细胞状态和操作细节。以下为优化的标准流程:
细胞准备阶段
将细胞接种于6孔板或含盖玻片的培养器皿中
培养过夜使细胞恢复自然状态,汇合度达80%左右为最佳
进行所需的药物处理或其他刺激处理
EdU工作液配制 用预热的完全培养基按1:500比例稀释10mM EdU母液
获得2×工作液(20μM)
关键提示:不要更换全部培养基,仅需等体积加入2×工作液
孵育与固定
→加入预热至37℃的2×EdU工作液
→37℃孵育精确2小时(多数哺乳动物细胞)
→弃培养液,加入4%多聚甲醛(PFA)室温固定15分钟
使用含3% BSA的PBS洗涤3次,每次5分钟
透化与点击反应
加入0.3% Triton X-100通透液室温处理10-15分钟
配制Click反应液(严格按顺序混合):
Click反应缓冲液
CuSO₄溶液
荧光叠氮化物(如Azide 488)
Click添加剂溶液
加入反应液覆盖样品,室温避光反应30分钟135
核染色与检测
用1:1000稀释Hoechst 33342(1×工作液)染色10分钟
PBS洗涤后即可观察
荧光显微镜检测通道:
Hoechst 33342:Ex/Em=346/460 nm(蓝)
Azide 488:Ex/Em=495/519 nm(绿)
注意要点:Click反应液必须现配现用(15分钟内使用),且组分添加顺序不可颠倒,否则反应效率将显著降低。
——03 悬浮细胞EdU处理关键技术
悬浮细胞的EdU标记面临独特挑战:细胞不易沉降、操作中易丢失、固定后难以附着。需采用特殊方法处理:
EdU标记与样本制备
在培养基中直接添加10μM EdU(终浓度)
37℃孵育2小时
关键差异点:需离心收集细胞(1000×g,5分钟)
沉淀用PBS重悬后制备细胞涂片:
载玻片上滴加细胞悬液
酒精灯温和烘干固定
固定与透化
→加入4%多聚甲醛室温固定15分钟
→含3% BSA的PBS洗涤3次
→0.5% Triton X-100通透处理15分钟
点击反应优化
配制Click反应液时增加10%体积
悬浮细胞更易产生背景信号
反应后建议:
→0.5% Triton X-100洗涤2次
→甲醇加强清洗(可选,高背景时使用)
→流式细胞术特殊处理
EdU孵育后无需制备涂片
先用培养基重悬细胞
再进行固定和透化
Click反应后直接上机分析
核心挑战应对:悬浮细胞在固定和洗涤步骤易丢失。解决方案包括:
低速离心(800-1000×g)
离心前加入载体蛋白(如1% BSA)
减少洗涤次数(不低于2次)
——04 组织样本与体内EdU标记方案
EdU技术不仅适用于体外培养细胞,还可实现活体水平的增殖检测,为组织再生、肿瘤生长等研究提供有力工具。
动物体内标记
小鼠给药方案:
腹腔注射EdU溶液
→剂量范围:10-200 mg/kg体重
→首次实验推荐50 mg/kg
给药方式选择:
腹腔注射(最常用)
局部组织注射
饮用水给药(长期标记)
时间控制:
标准时间:4小时
可根据研究目的延长至24小时
组织样本处理
处死动物后迅速取材
冰冻切片制备:
4%多聚甲醛固定15分钟
0.3% Triton X-100透化15分钟
石蜡切片制备:
常规脱蜡(二甲苯-乙醇梯度)
抗原修复非必需(EdU检测无需抗体)
切片EdU检测
切片厚度建议:5-7μm
直接进行Click反应(30分钟)
可选核染色(DAPI或Hoechst)
封片观察
特别提示:若同时进行目标蛋白的免疫荧光染色,且需抗原修复时:
避免使用蛋白酶K或胰酶处理
选择热介导的抗原修复法
修复后彻底清洗,防止酶残留干扰点击反应
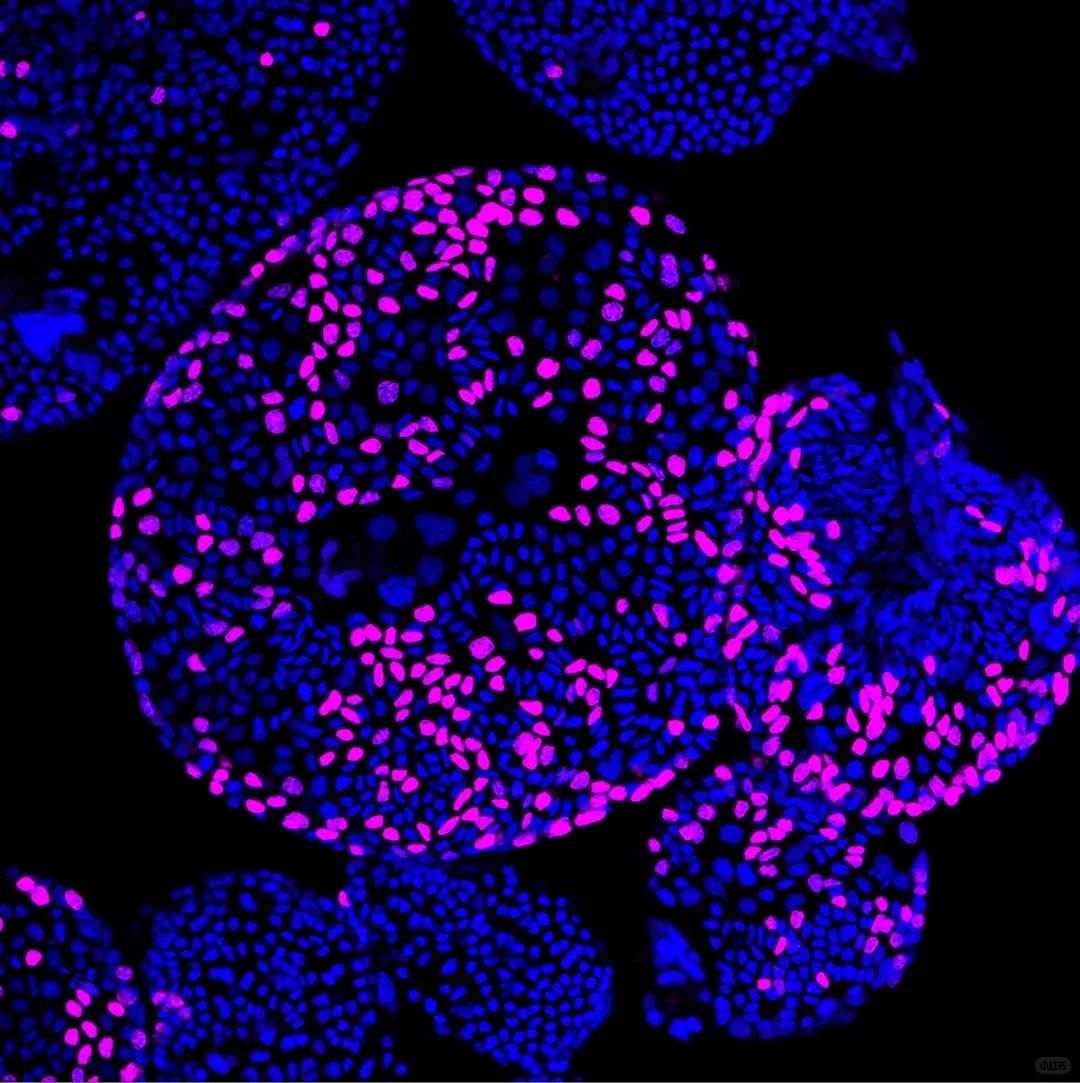
——05 实验失败常见原因与解决方案
即使经验丰富的科研人员也可能遭遇EdU检测的陷阱。以下为常见问题及专业解决方案:
标记信号弱或无信号
浓度不足:对生长缓慢细胞(如神经细胞),可将 EdU 浓度提高至 50μM;对快速增殖细胞(如胚胎细胞),可缩短孵育时间(如 1 小时),无需提高浓度(避免细胞毒性)
孵育时间不当:确认细胞周期时间,调整占周期10%左右
反应液失效:Click反应液配制后须15分钟内使用,且必须按缓冲液→CuSO₄→Azide→添加剂的顺序混合
背景信号过高
洗涤不充分:增加Triton X-100洗涤次数(最高5次),每次10分钟
非特异性结合:BSA浓度提高至5%,或添加5%正常血清封闭
细胞碎片干扰:上样前通过40μm细胞筛过滤
细胞形态损伤
→透化过度:降低Triton X-100浓度至0.1%或缩短处理时间
→固定过久:多聚甲醛固定不超过15分钟
→悬浮细胞脆弱:离心速度不超过1000×g,重悬时避免吹打
多重染色干扰
荧光串扰:优化滤光片设置,顺序拍摄不同通道
抗体交叉反应:先进行免疫染色,后执行Click反应
自发荧光:使用新鲜配制的抗淬灭封片剂
——06 方案优化与新技术进展
随着技术进步,EdU实验方案也在不断优化。以下为提升数据质量的进阶策略:
动态监测技术:通过脉冲追踪实验设计,可实现细胞周期进程的连续监测。
方法:
首次EdU标记(10μM,30分钟)
更换普通培养基
不同时间点固定细胞
使用不同颜色Azide(如Alexa Fluor 555)二次标记
高通量筛选适配:
96/384孔板微型化体系
Click反应液体积缩减至50μL(96孔板)
自动化加样设备兼容
高内涵成像系统分析
表:不同培养容器Click反应体系配置参考
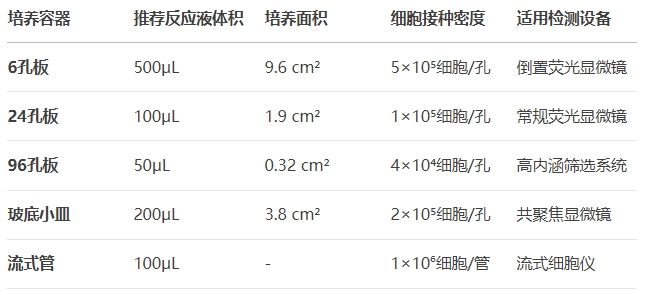
三维培养系统:类器官和球状体模型的EdU标记需特殊处理:
增加EdU渗透时间(至4小时)
透化时间延长至1小时
振动培养促进试剂渗透
流式分析优化:
贴壁细胞消化后固定
Azide 594标记更适合红色激光流式细胞仪
结合PI或7-AAD进行细胞周期同步分析
冷冻样本处理:
冻存组织切片可进行EdU检测
避免反复冻融
增加通透时间至30分钟
细胞增殖研究正从二维培养走向类器官,从终点检测走向实时动态监测。10μM EdU孵育2小时作为经典方案,其价值不仅在于结果本身,更在于其作为标准化基准,使跨实验室数据比较成为可能。
如果想知道更多的关于的EDU检测细胞增殖相关案例和知识点,以及专属研究方法,也可以联系我们:18570028002 或 微信 pulateze666会把这些资料发送给大家哦。

