

EdU实验避坑指南:浓度、孵育时间、通透剂选择全解析(附案例)
 2025-06-30 18:15:04
2025-06-30 18:15:04
来源/作者:普拉特泽-生物医学整体课题外包平台
EdU实验避坑指南由普拉特泽生物为大家总结分享,普拉特泽生物细胞实验平台专业承接细胞衰老、细胞诱导/分化、细胞侵袭等细胞实验代做服务,积累专业丰富的实验操作经验。上期我们分享EdU检测大家都说不够详细,有一些注意事项没有写出来,那今天咱们就为大家专门出一期EdU实验避坑指南,快点学起来吧!
结合实战经验与文献数据,系统解析避坑策略,助大家获得清晰可靠的增殖数据。
核心优势回顾——为何EdU是更优解?
▲免变性,EdU 通过点击化学(Click Chemistry)与荧光叠氮化物染料直接结合
▲小分子,深渗透:EdU 检测所用荧光叠氮化物染料分子量(~500 Da)仅为 BrdU 抗体的 1/500
▲快流程,高效率: 操作步骤从BrdU的≥4小时缩短至约1.5小时 (孵育+检测),省去过夜抗体孵育与抗原修复。
避坑提示: 若实验需共标精细细胞结构(如神经元树突)或多种蛋白,EdU是唯一选择,BrdU的变性步骤必然导致结构破坏。
关键参数避坑解析与优化方案
1. EdU浓度:过低无信号,过高有毒性
“坑”点:
浓度过低 → 掺入DNA的EdU量不足 → 荧光信号弱/假阴性。
浓度过高 → 激活DNA损伤响应(如p53通路)→ 干扰细胞周期,甚至诱导凋亡。
优化策略(梯度摸索是王道!):
基础原则: 短时间孵育用高浓度,长时间孵育用低浓度。
参考起点 (体外细胞):
→快速增殖细胞 (HeLa, A549, 293T):10-20 μM
→原代/慢周期细胞 (神经元前体, 干细胞):20-50 μM
→体内注射 (小鼠):5 mg/kg (溶于PBS)
必做验证: 设置浓度梯度(如5, 10, 20, 50 μM),孵育后检测信号强度与细胞活性(CCK8/PI染色。
表:细胞类型特异性EdU浓度与时间推荐
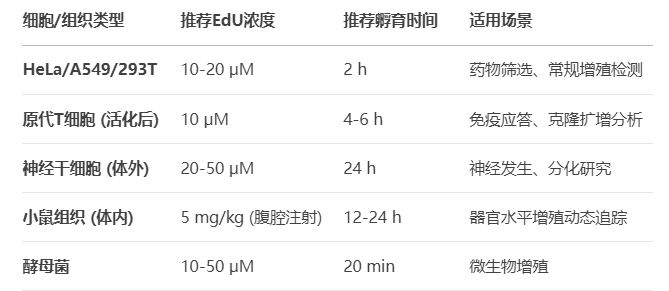
2. 孵育时间:过短漏检,过长伤细胞
“坑”点:
●时间过短 → 仅极少数处于S期后期的细胞被标记 → 低估增殖率。
●时间过长 → 同上,高浓度长期暴露加剧毒性,且非特异性背景可能升高。
优化策略(锚定细胞周期):
●黄金法则: 孵育时间 ≈ 细胞周期长度的10% 。
常见参考:
●哺乳细胞系 (周期~24h):2小时 是安全起点。
●胚胎细胞 (周期~30min):5分钟。
●体内实验:12-24小时 覆盖更多增殖细胞。
动态研究: 采用 “脉冲-追踪” (Pulse-Chase) 策略:短时高浓度EdU标记 → 更换正常培养基培养 → 在不同时间点检测,可分析细胞周期进程。
避坑提示2: 对未知细胞周期的新细胞类型,建议先用流式细胞术PI染色测定其周期时长,再推算EdU孵育时间。
3. 通透剂选择:不足阻试剂,过度毁结构
“坑”点:
▲通透不足 → Click反应试剂无法充分接触核内EdU → 信号弱且不均匀(边缘强中心弱)。
▲通透过度 → 细胞膜/核膜破裂,细胞形态塌陷 → 无法共定位或高清成像。
优化策略(匹配样本类型):
通用首选:0.3%-0.5% Triton X-100 (溶于PBS),室温 10-20分钟。适用于大多数贴壁细胞和软组织。
替代方案:
▲温和型:0.1%-0.5% 皂苷 (Saponin) → 在膜上“打孔”但不溶解,保留膜蛋白(如GPCR、通道蛋白)完整性,适合需共标膜蛋白的实验。
▲强力型:冷甲醇 (-20°C, 10min) → 溶解脂质双分子层,穿透力极强,适用于骨组织、致密肿瘤组织,但会破坏脂质相关结构。
▲酶辅助:胶原蛋白酶IV/透明质酸酶 → 预处理高度纤维化组织或富含胞外基质的组织(如肝纤维化、实体瘤),提高试剂渗透性。
组织切片特别提示: 采用梯度通透法(如0.1% → 0.3% → 0.5% Triton,每步30-40min),减少组织脱落与边缘效应。
标准操作流程 (SOP) 与关键避坑步骤
关键避坑细节:
→固定: 使用新鲜配制、pH 7.4的4%多聚甲醛(PFA),室温固定≤15分钟。过度固定(>30min或高浓度戊二醛)会严重遮蔽抗原和EdU位点。
→中和: 固定后务必使用 甘氨酸 (2mg/mL) 或 NH₄Cl 淬灭残留醛基,减少背景荧光。
→Click反应顺序: 务必先完成EdU点击反应,再进行抗体染色! 铜离子催化剂可能破坏抗体结构。
染料选择:
□组织样本: 首选 AF647 (远红) 或 Pacific Blue (蓝),避开绿色/黄色自发荧光区域。
□含GFP的细胞: 避开488通道,选 AF594 (橙红) 或 AF647 。
洗涤: Click反应后,用含 0.5% Triton的PBS 充分洗涤(2-3次,每次10min),去除未结合染料。顽固背景可加一步 甲醇短时清洗 (5min)。
实战案例解析:避坑方案的应用
案例1:脑切片EdU检测 - 解决“中心无信号”
问题: 小鼠海马区注射EdU后,冰冻切片中心区域信号微弱,边缘强。
诊断: 通透不足(标准0.5% Triton 15min对厚脑组织不够)。
优化:
通透剂:0.3% Triton + 0.1% 皂苷混合液,4℃通透2小时(温和延长)。
辅助:1mM EDTA 加入通透液,保护髓鞘结构。
结果:中心神经元EdU信号清晰显现,与NeuN共定位成功。
案例2:药物筛选实验 - 避免“假阴性”
问题: 测试某抗癌药对肝癌细胞HepG2的抑制效果,EdU阳性率无变化,但CCK8显示抑制。
诊断: EdU浓度(10μM)与时间(2h)未优化,药物可能延长细胞周期。
优化:
延长孵育时间至 6小时(覆盖更慢S期)。
浓度微调至 15μM。
结果:药物组EdU⁺细胞显著减少40%,与表型吻合。
案例3:流式多色分析 - 消除“通道串扰”
问题: EdU (AF488) + CD4 (PE) 双标流式,补偿调节困难,信号重叠。
诊断: AF488与PE光谱重叠严重。
优化:
EdU染料更换为 AF647(远红通道)。
Click反应后,再进行CD4-PE抗体染色。
结果:流式图中两群细胞清晰分群,准确分析CD4⁺T细胞增殖
高频故障排除表

成功EdU实验的黄金法则
浓度时间个性化: 拒绝“一刀切”!依据细胞类型/周期严谨优化EdU浓度与孵育时间。
→通透剂按需匹配: Triton通用,皂素保膜,甲醇破硬,组织切片需梯度或酶辅助。
→操作顺序不可逆: EdU Click反应 优先于 抗体染色。
→染料通道巧避让: 组织用远红/蓝,含GFP细胞避绿,消除串扰与自发荧光。
→对照实验必做: 包括未加EdU阴性对照、已知高增殖阳性对照,以及浓度/时间梯度测试。
欲获得更多的信息和帮助,可通过以下方式联系:
流式检测|病理检测|动物模型|实验服务|分子操作|免疫相关检测
免费热线:18570028002

