

流式检测细胞周期原理及实验步骤分析——科研小白
 2022-03-09 14:29:36
2022-03-09 14:29:36
来源/作者:普拉特泽-生物医学整体课题外包平台
大家好,今天我们来讲一讲用流式检测细胞周期的实验原理和详细步骤,本文是普拉特泽生物根据承接的几千例流式检测外包实验与同学们的技术咨询分析,发现相当一部分来外包实验和技术咨询的问题都是流式检测相关的实验,特别是流式检测细胞周期,既然这个实验折磨了大家这么久,那这一篇,我们就来好好地给科研小白们盘一盘吧!

一、流式检测细胞周期实验原理
流式利用不同荧光物质标记的单克隆抗体,与待测成分作用,然后上流式细胞仪检测待测细胞。待测细胞随流动室内的流动鞘液排列成单列,一个个迅速通过激光聚焦区,激光在对每个细胞进行照射时可同时得到前向角散射和侧向角散射2种散射光以及激发荧光标记物发出的信号,利用这些信号,可计算出相对含量,从而得到细胞群的相对比值。
细胞周期分为间期与分裂期两个阶段。间期又分为三期:即DNA合成前期(G1期)、DNA合成期(S期)与DNA合成后期(G2期)。某些细胞在分裂结束后暂时离开细胞周期,停止细胞分裂,执行一定生物学功能(G0期)。由于细胞周期各时相的DNA含量不同,通常正常细胞的G1/G0期具有二倍体细胞的DNA含量(2N),而G2/ M期具有四倍体细胞的DNA含量(4N),而S期的DNA含量介于二倍体和四倍体之间。PI可以与DNA结合,其荧光强度直接反映了细胞内DNA含量。因此,通过流式细胞仪PI染色法对细胞内DNA含量进行检测时,可以将细胞周期各时相区分为G1/G0期,S期和G2/M期。
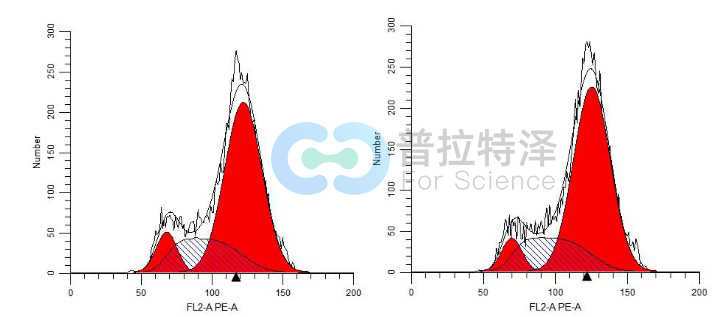
二、流式检测细胞周期实验详细步骤
1、培养细胞周期待测细胞:在合适的温度、营养、酸碱度条件下通过细胞培养既可以获得大量细胞,可以借此研究细胞周期、细胞的信号转导、细胞的合成代谢、细胞的生长增殖等实验。细胞培养时间:一般药物等处理时间最好是大于细胞增殖一代的周期,可根据具体细胞分裂时间决定,如乳腺癌细胞我们一般处理24小时。这里就不展开讲啦,感兴趣的同学可以看看另一篇文章:原代细胞培养和传代培养该用什么方法?
2、收集检测细胞周期的细胞:收集细胞取适量的对数生长期细胞接种于6厘米中,在相应的条件下(如药物)处理相应时间后,倒去培养基,用胰酶适度消化细胞,离心收集细胞,弃去上清。细胞数量:一般情况下,由于在细胞周期中分析的细胞数应达到1.0*104~3.0*104才具有统计学意义。因此,单次流式细胞仪检测细胞周期时,1份样品的细胞数量至少为106。
3、清洗及固定检测细胞周期的细胞:用PBS清洗细胞2遍,吸净离心管残余的PBS后,加入300微升PBS重悬,将细胞吹散,避免细胞成团,随后将细胞悬液逐滴滴入700uL无水乙醇(预冷),即用70-75%的乙醇固定细胞,然后4℃固定过夜。由于流式分析时需要的是单个细胞悬液,因此在操作过程中需充分混悬细胞,细胞固定后,不可过度吹打细胞,以防产生过多的细胞碎片。
4、再次洗涤检测细胞周期的细胞:第二天,离心收集细胞,用移液枪吸走上清,然后用1mLPBS重悬细胞并离心清洗2~3遍。细胞可以长期保管在-20℃,可存放1个月,染色不会受影响;用PBS重悬细胞时,动作要轻柔。此外,离心速度(1200rpm/min)不要过快以免造成细胞的破裂。
5、避光孵育待测细胞:RNA酶消化和PI染色在避光条件下,每个样品加入1避光RNase(10mg/mL)和5 mg/m(5mg/mL)混匀后室温避光条件下孵育30min
6、上流式细胞仪检测:将检测样品转移到5mL的流式管后用流式细胞仪检测细胞周期,采用flowjo或 modifit软件进行DNA含量分析,上机检测时,必须重悬成细胞悬液后再检测,否则容易堵仪器管道;如果细胞过多或聚团严重,可先用300尼龙网过滤,然后再上机检测。
那么以上就是用流式检测细胞周期的原理和详细实验步骤啦,关于流式的结果分析怎么看,请点击:流式结果怎么看【干货分享】
大家都学会了吗?还有其他技术问题或者需要流式检测细胞周期实验外包的朋友可以留言联系我们哦~

