

EdU检测细胞增殖:高灵敏度+无DNA变性
 2025-06-23 14:42:05
2025-06-23 14:42:05
来源/作者:普拉特泽-生物医学整体课题外包平台
一次点击化学反应,让增殖细胞无处遁形,更让繁琐的DNA变性步骤成为历史
我们经常被一个难题所困扰:如何在精准标记DNA复制活跃细胞的同时,保持细胞结构的完整性?传统BrdU检测法虽然广泛应用,但其依赖的DNA变性步骤如同一把双刃剑——在暴露抗原表位的同时,也破坏了细胞的原始形态和生物分子网络。今天普拉特泽生物继续带大家一起学习新实验~
EdU检测原理
EdU(5-Ethynyl-2’-deoxyuridine)是一种胸腺嘧啶核苷类似物,其分子结构中的乙炔基团取代了胸苷的甲基基团。这一微小却关键的变化,赋予了它革命性的检测优势。
在细胞增殖过程中,当DNA进入合成期(S期),EdU能够替代天然胸苷掺入新合成的DNA链中。与传统BrdU不同,EdU的检测不依赖大分子抗体识别,而是通过“点击化学”(Click Chemistry)实现——乙炔基与荧光标记的叠氮化物在铜离子催化下,形成稳定的三唑环。
这一反应具有高度特异性和高效性,可在30分钟内完成,且对细胞结构几乎无扰动。
其结果就是:增殖细胞被精准标记,而细胞核、膜蛋白及其他胞内抗原保持原始状态,为多重分析铺平道路。
高灵敏度与免变性的技术优势
高灵敏度:
EdU检测染料的分子量仅为BrdU抗体的1/500,使其在细胞内扩散效率显著提升。这种小分子特性带来两大核心优势:
▲单细胞分辨率:即便组织中仅存在单个增殖细胞,也能被准确识别
▲信号强度提升3-5倍:直接化学结合避免了抗体结合效率损失,微弱增殖信号清晰可辨
▲在临床前研究中,这一灵敏度优势已被转化为实际价值。例如在乳腺癌类器官药物筛选中,EdU+Ki-67双标揭示的癌细胞抑制率较BrdU提升40%,为药物疗效评估提供了更可靠的依据。
无DNA变性:保护样本完整性的技术突破
●传统BrdU检测的致命瓶颈在于DNA变性步骤:盐酸处理、高温或酶解不仅耗时(≥4小时)更导致:
●细胞核形态破坏:核膜皱缩、染色质弥散,影响成像质量.
●抗原表位损毁:难以与胞内蛋白标记(如Ki-67、磷酸化组蛋白)联用.
而EdU检测彻底摒弃了变性需求。通过温和的固定透化处理(4%多聚甲醛+0.5% Triton X-100),细胞三维结构、表位完整性和DNA高级结构均得以保全。这不仅让细胞核边缘清晰可见,更开启了多参数分析的大门。
效率跃升,操作流程的极速简化
将EdU检测与BrdU流程并置对比,其效率优势一目了然:
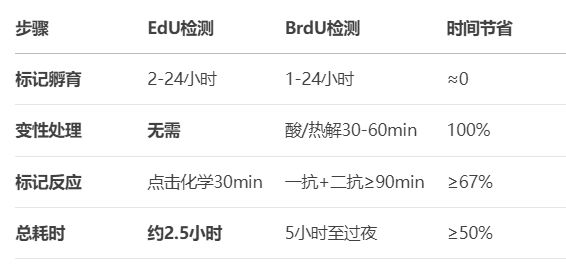
操作流程的精简不仅体现在时间上:
●步骤减少40%:从BrdU的约10步缩减至6步核心操作
●试剂毒性降低:避免接触盐酸及DNase,提升实验安全性
●自动化兼容性高:适用于高通量筛选平台(如96/384孔板)
应用场景,多领域研究的适配性
复杂模型中的精准增殖分析
▲3D类器官与组织切片:EdU小分子可渗透至类器官深层,在冰冻/石蜡切片中实现均一标记
▲活体动态追踪:通过腹腔注射(5 mg/kg)标记小鼠模型,结合组织透明化技术实现全器官增殖图谱构建
多组学关联研究
免疫表型关联:流式检测中EdU与CD分子标记兼容,同时解析T细胞增殖与活化状态
细胞周期同步分析:配合DAPI核染色,可计算S期细胞比例及G1/S/G2-M期分布
荧光蛋白共定位:适用于转基因荧光蛋白细胞系,活体追踪增殖干细胞迁移
前沿技术融合
AI图像分析:深度学习模型训练中,EdU标记的清晰核轮廓显著提升自动识别准确率
空间转录组整合:组织切片EdU信号可与测序数据叠加,关联增殖热点与基因表达域
操作实践,关键步骤优化指南
●EdU标记方案设计
浓度优化:快速增殖细胞(如肿瘤细胞系)推荐10 μM × 2小时;慢周期细胞(如神经元前体)可提高至50 μM × 24小时
脉冲-追踪设计:短脉冲(2h)标记高活性群体;长追踪(24h)覆盖全周期细胞
●样本处理要点
●固定剂选择:4%多聚甲醛优于醇类固定剂,避免DNA结构改变
●透化关键:0.5% Triton X-100处理≤20分钟,过度透化将导致信号扩散
●铜毒规避:添加铜螯合剂(如Click添加剂)保护敏感细胞表位
信号增强策略
●叠氮染料选择:Alexa Fluor 647适用于深组织成像;Pacific Blue适合多色流式分析
●酪胺信号放大:低增殖样本可使用TSA系统放大信号,避免背景升高
常见问题解答,破解实验痛点
Q1:EdU是否影响细胞活力或周期进程?
常规浓度(≤10 μM)孵育24小时内,对细胞周期无显著影响。但长期孵育(>48h)或高浓度(>50 μM)可能引发DNA损伤反应,建议设置浓度梯度验证。
Q2:如何降低点击化学的背景噪音?
关键在铜离子控制:添加抗氧化剂(如抗坏血酸钠)及优化Cu²⁺浓度(通常0.1-1 mM)。使用Click-iT Plus试剂盒可兼容R-PE等易淬灭染料。
Q3:能否与BrdU抗体联用进行双标记?
可行!EdU点击反应后,通过DNase温和处理暴露BrdU表位,可实现“新旧”增殖细胞谱系追踪。
Q4:组织切片透化不足如何解决?
推荐梯度透化法:先0.1% Triton X-100处理10分钟,检测信号强度;若不足则升至0.3%,避免超过0.5%导致组织解离。
未来演进,技术边界持续拓展
随着2025年新型探针的开发,EdU技术正向更高维度进化:
▲近红外探针:如Alexa Fluor 790叠氮化物(Ex/Em:785/814 nm),提升活体成像穿透深度
▲多核苷酸联用:F-ara-EdU(5-fluorinated-arabinosyl EdU)同时实现增殖标记与细胞周期阻断,用于同步化研究
▲非天然氨基酸整合:结合HaloTag技术,在检测增殖同时标记新生蛋白
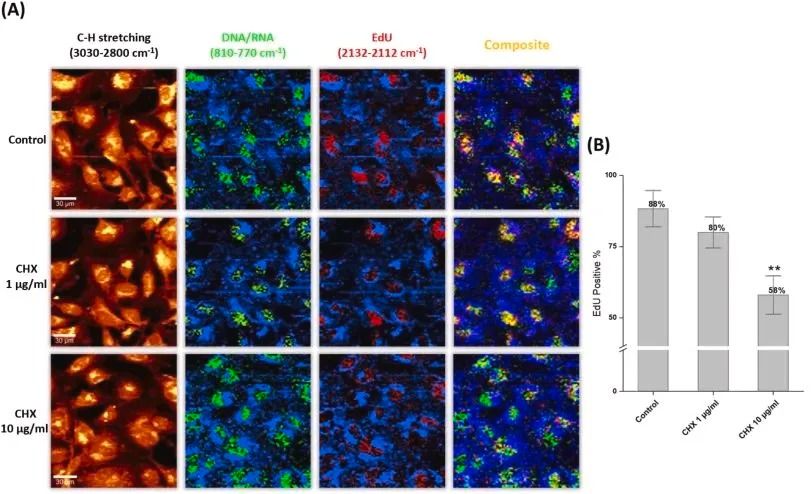
当德国癌症研究中心的团队首次将EdU应用于脑肿瘤干细胞动态追踪时,他们观察到了意想不到的现象:那些处于静息状态的肿瘤干细胞,在常规BrdU标记中因长周期被忽略,却通过EdU脉冲追踪显露出复苏迹象。
这一发现不仅解释了肿瘤复发的细胞学基础,更彰显了EdU技术在解析细胞增殖异质性中的无可替代性。
冰冻三尺,非一日之寒,普拉特泽致力于帮助广大科研工作者解决EdU细胞实验中的各方面问题,不但授人以鱼,亦授人以渔。

扫码添加:可咨询问题
