

细胞增殖vs细胞毒性检测:实验设计与结果关联性深度解析
 2025-05-16 15:31:20
2025-05-16 15:31:20
来源/作者:普拉特泽-生物医学整体课题外包平台
在药物筛选、肿瘤研究及毒理学评估中,细胞增殖与细胞毒性检测是两大核心实验。然而,许多研究者常因混淆两者的检测原理或误判数据关联性,导致结论偏差。普拉特泽生物工具平台为广大科研工作者提供细胞实验外包服务,更有自己的实验室专业操作实验;本文将系统解析两种检测方法的差异,并提供实验设计与结果解读的实用指南。
一、检测原理与适用场景对比
1. 细胞增殖检测
核心原理:量化细胞分裂或代谢活性,反映细胞生长能力。
常用方法
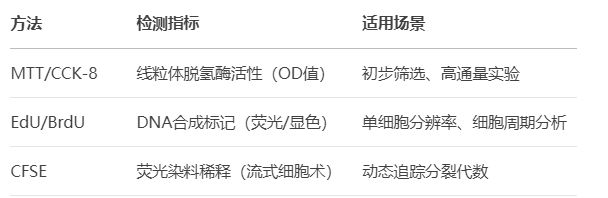
关键应用:
▲评估生长因子、激素或药物对细胞增殖的促进/抑制效应。
▲肿瘤细胞对化疗药物的敏感性测试。
2. 细胞毒性检测
核心原理:评估细胞膜完整性或代谢功能损伤,反映细胞死亡或功能障碍。
常用方法:
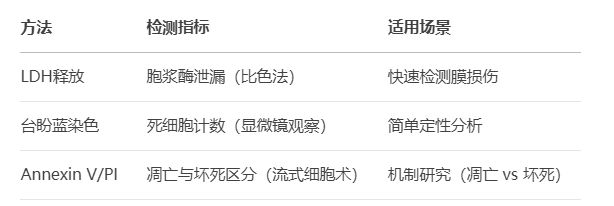
关键应用:
①药物或化合物的急性毒性评估。
②环境污染物对细胞的损伤效应分析。
二、实验设计关键差异
1. 时间节点选择
增殖检测:需覆盖多个细胞周期(通常24-72小时),观察动态变化。
毒性检测:急性毒性多在6-24小时检测,慢性毒性可延长至48小时以上。
2. 药物处理策略
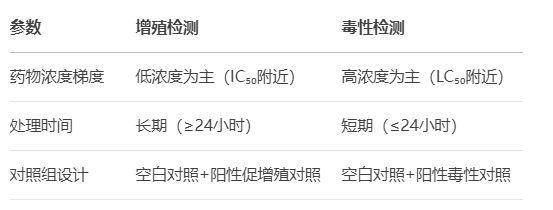
3. 结果解读误区
假阳性增殖抑制:
▲细胞毒性导致代谢活性下降(如MTT检测中药物直接抑制线粒体酶)。
▲解决方案:联用LDH释放检测,区分死亡细胞与活性抑制。
假阴性毒性:
▲药物仅抑制增殖但未杀死细胞(EdU阳性率下降但LDH未升高)。
▲解决方案:结合凋亡标记(如Caspase-3活性检测)。
三、关联性分析:如何整合两类数据
1. 分阶段检测策略
第一阶段(24小时):LDH释放检测评估急性毒性。
第二阶段(48-72小时):CCK-8检测评估增殖抑制效应。
优势:明确区分短期杀伤与长期生长抑制。
2. 数据标准化方法
增殖率校正公式:
\text{校正增殖率} = \frac{\text{实验组OD} - \text{毒性死亡细胞OD}}{\text{对照组OD} - \text{毒性死亡细胞OD}} \times 100\%
示例:若某药物组OD值为0.8,对应毒性死亡细胞OD为0.2,对照组OD为1.5,则校正增殖率 = (0.8-0.2)/(1.5-0.2) ×100% = 46.2%。
3. 典型案例解析
案例:抗癌药物筛选
现象:药物A处理48小时后,CCK-8显示OD值下降60%,但LDH释放仅增加10%。
解读:
主要效应为增殖抑制(细胞存活但停止分裂),而非直接毒性。
进一步验证:EdU染色显示S期细胞减少,凋亡流式检测无显著变化。
四、实验优化与常见问题
1. 方法选择建议
优先组合:CCK-8 + LDH双检测(成本低、操作简便)。高精度需求:EdU + Annexin V/PI流式分析(机制深入解析)。
2. 避免干扰的实操技巧
CCK-8/MTT干扰:
药物自身吸光度高?改用CellTiter-Glo(化学发光法)。
血清干扰?检测前更换无血清培养基。
LDH假阳性:
细胞冻融或机械损伤导致酶泄漏?规范操作,轻柔换液。
3. 数据呈现规范
图表示例:
折线图:不同浓度下增殖率与毒性率的对比。
热图:多时间点联合检测结果(绿色=增殖,红色=毒性)。
五、总结:关键决策树
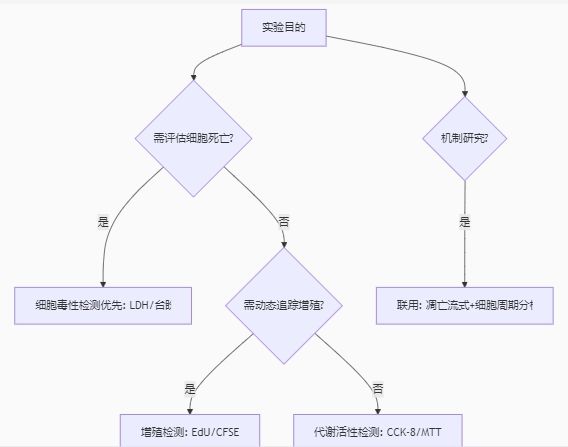
如果你总是在做实验时总会遇上这样那样的问题需要帮助时,请记得在细胞增殖实验中遇到技术问题可添加技术微信:18570028002
我司还提供细胞增殖实验外包服务或实验培训
