

如何避免细胞毒性干扰?增殖实验背景控制的3大核心策略
 2025-05-16 14:33:51
2025-05-16 14:33:51
来源/作者:普拉特泽-生物医学整体课题外包平台
Question:如何避免细胞毒性干扰?(普拉特泽生物提供长期稳定的细胞实验外包服务)
答:细胞增殖实验(如MTT、CCK-8、EdU)是评估药物毒性、肿瘤生长和干细胞活性的核心方法,但实验背景干扰和细胞毒性问题导致高达50%的数据不可靠。本文基于《Nature Protocols》最新标准和实验室实战经验,解析3大核心策略,助您精准排除干扰,获得高质量数据!
一、细胞毒性来源分析:识别隐藏的“数据杀手”
1. 试剂直接毒性

2. 操作诱导应激
①机械损伤:移液过猛导致细胞脱落(贴壁细胞需轻柔换液)。
②温度波动:试剂未平衡至室温直接加入,引发细胞冷休克。
3. 交叉污染干扰
①血清中生长因子残留影响基线数据。
②实验器皿清洁不彻底(如残留洗涤剂抑制代谢活性)。
二、策略一:优化实验设计与试剂选择
1. 检测方法升级
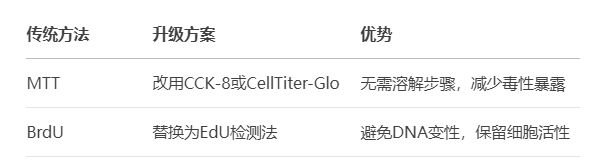
2. 关键试剂筛选
血清批次验证:新批次血清需与旧批次平行培养细胞,确认增殖率差异<10%。
低毒性替代品:
⑴用WST-8替代MTT(毒性降低80%)。
⑵选择无动物源成分的培养基(如Gibco CTS系列)。
3. 梯度预实验设计
药物浓度梯度:设置至少5个浓度点,确定IC₅₀和最大安全浓度。
时间梯度测试:对比不同孵育时间(如2h/4h/6h)对细胞活性的影响。
三、策略二:精细化操作流程
1. 细胞处理标准化
铺板均一性:
▲使用多通道移液器(误差<5%)。
▲预实验确定最佳密度(推荐贴壁细胞5×10³~1×10⁴/孔)。
换液技巧:
▲倾斜培养板45°缓慢吸液,避免损伤单层细胞。
▲PBS清洗次数≤2次(防止细胞脱落)。
2. 背景信号控制
●空白对照设置:每板包含无细胞孔(仅培养基+试剂)。
●血清干扰消除:检测前更换为无血清培养基,孵育2小时。
边缘效应应对:
96孔板外围孔加PBS缓冲液。
培养箱湿度维持>90%,减少蒸发差异。
四、策略三:数据验证与质控体系
1. 双重验证法
活死细胞共染色:
联用Calcein-AM(绿色,活细胞)和PI(红色,死细胞)。
流式细胞术定量活细胞比例,验证增殖数据可靠性。
2.ATP含量检测:
使用CellTiter-Glo化学发光法,交叉验证代谢活性。
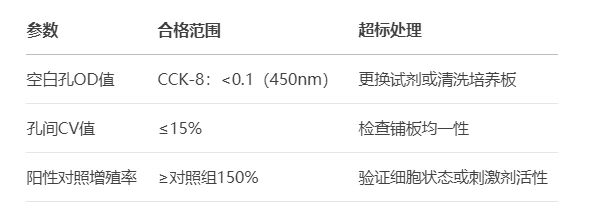
五、实战案例:从失败到成功的优化路径
▲案例背景
某实验室在抗癌药物筛选中发现CCK-8数据波动大,高浓度组OD值异常升高。
▲问题诊断
药物自身吸光度干扰(λ=450nm)。
血清批次差异导致基线漂移。
▲解决方案
①改用CellTiter-Glo(化学发光法,避光检测)。
②检测前更换为无血清培养基,消除血清干扰。
③增加活死细胞双染色验证。
结果
数据CV值从25%降至8%,筛选出3个有效候选化合物
六、常见问题解答(FAQ)
Q1:如何判断细胞毒性来自试剂还是操作?
设置“无处理对照组”和“仅试剂对照组”:若仅试剂组活性下降>20%,提示试剂毒性。
Q2:高背景信号如何紧急处理?
立即终止实验,用PBS清洗3次后更换新鲜培养基,重新检测。
Q3:EdU检测中出现高背景荧光怎么办?
优化透化时间(0.5% Triton X-100处理≤20分钟),减少非特异性结合。
七、资源推荐
1. 低毒性试剂
CCK-8试剂盒(Dojindo,货号CK04)
CellTiter-Glo 3D(Promega,货号G9683)
2. 实用工具
自动细胞计数器(Countess II,Thermo Fisher)
多通道移液器(Eppendorf Research plus)
冰冻三尺,非一日之寒,普拉特泽致力于帮助广大科研工作者解决学术写作和发表中的各方面问题,不但授人以鱼,亦授人以渔。
还可以加我们实验交流群哦~~

