

细胞侵袭检测技术及Transwell实验全解析
 2025-05-22 14:15:36
2025-05-22 14:15:36
来源/作者:普拉特泽-生物医学整体课题外包平台
细胞侵袭是肿瘤转移、伤口修复等生理病理过程的核心环节普拉特泽生物为广大生命科学研究人员提供细胞侵袭实验,可根据实方案的要求选择不同的检测方法,就跟大家一起继续探究系统解析细胞侵袭检测技术
并重点详解Transwell实验的原理与操作步骤,助力科研工作者高效开展实验。
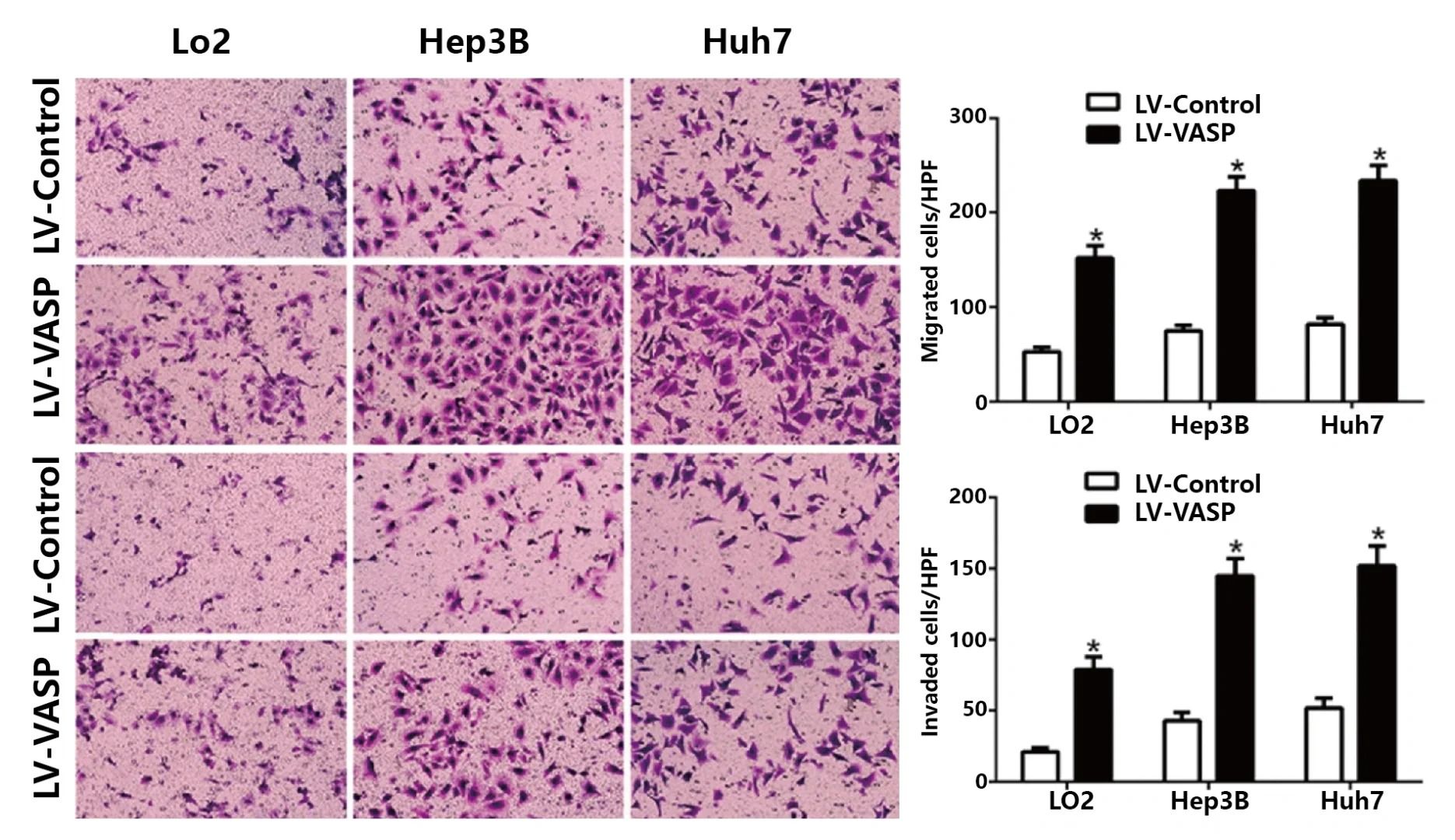
一、细胞侵袭检测技术分类
1. 传统体外检测方法
▲Transwell实验:通过聚碳酸酯膜分隔上下室,上室铺基质胶(如Matrigel)模拟细胞外基质(ECM),检测细胞降解基质并迁移的能力。
▲Boyden小室法:类似Transwell,但采用预涂基底膜提取物(BME)的PET膜,结合荧光标记定量分析16。

2. 高通量与实时监测技术
●Oris™平台:基于96孔板设计,通过实时成像分析细胞侵入无细胞区域的面积,适用于大规模筛选。
●CIM-Plate结合RTCA分析仪:利用电阻抗变化实时监测侵袭过程,无需染色,灵敏度高。
●3D细胞培养模型:结合水凝胶或生物打印技术,模拟体内微环境,更贴近生理条件。
二、Transwell实验原理与操作步骤
1. 实验原理
Transwell实验通过聚碳酸酯膜(孔径8-12 μm)分隔上下室,上室铺Matrigel胶模拟基底膜。细胞需分泌基质金属蛋白酶(MMPs)降解基质
在趋化因子(如血清或纤维粘连蛋白)驱动下穿过膜进入下室,通过计数下室细胞评估侵袭能力。
关键区别:侵袭实验需铺胶,而迁移实验无需基质胶。
2. 操作步骤详解
步骤:基质胶铺板
●Matrigel处理:提前12小时从-20℃转移至4℃解冻,用无血清培养基按1:8稀释(需预实验优化比例)。
●铺胶方法:取100 μL稀释胶液均匀涂布于Transwell膜上,37℃孵育1小时成凝胶,避免气泡。
步骤2:细胞悬液制备
●细胞预处理:对数期细胞经无血清培养基饥饿处理12-24小时,减少血清干扰。
●悬液调整:离心后以无血清培养基重悬,调整密度至1-10×10⁵/mL(具体依细胞类型优化)。
步骤3:细胞接种与培养
●下室加液:加入500-650 μL含5%-10% FBS的培养基作为趋化源28。
●上室接种:加入100-200 μL细胞悬液,避免气泡干扰趋化梯度,培养12-48小时(依细胞侵袭力调整)。
步骤4:固定与染色
去除未迁移细胞:棉签轻柔擦拭上室表面,PBS清洗后4%多聚甲醛固定20分钟。
染色方法:0.1%结晶紫染色5-10分钟,PBS冲洗后显微镜观察。
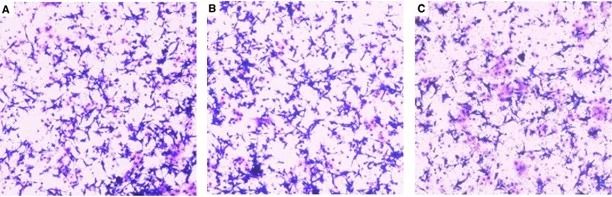
步骤5:结果分析
直接计数法:随机选取5个视野,计数下室细胞(适用于细胞量适中)。
间接检测法:若细胞过多,可用醋酸脱色后测OD值(570 nm)。
三、实验优化与常见问题
1. 关键注意事项
▲气泡控制:接种时避免气泡,否则趋化梯度失效。
▲基质胶厚度:过薄导致假阳性,过厚延长实验时间。
▲细胞密度:过高导致计数困难,过低可能漏检。
2. 常见问题与解决策略
●细胞不侵袭:
检查MMPs表达(如MMP-2),饥饿处理增强侵袭性。
确认孔径选择(实体瘤常用8 μm)。
●结果重复性差:
标准化操作流程,预实验优化条件。
四、技术应用与前沿进展
Transwell实验广泛应用于肿瘤转移机制研究、药物筛选(如MMP抑制剂)及免疫细胞趋化分析。近年结合人工智能图像分析(如ImageJ自动化)和单细胞测序,可动态解析侵袭相关基因表达。
今天关于细胞侵袭检测技术就分享到这儿啦~如果您在实验过程中遇到技术问题,或者需要实验外包和代做,可与我们技术老师联系18570028002(微信同号)

