

ChIP 实验怎么做?完整步骤解析与操作指南
 2025-07-08 13:45:09
2025-07-08 13:45:09
来源/作者:普拉特泽-生物医学整体课题外包平台
染色质免疫沉淀(Chromatin Immunoprecipitation, ChIP)是研究蛋白质-DNA相互作用的核心技术,广泛应用于转录因子结合、组蛋白修饰、表观遗传调控及染色质结构分析。
普拉特泽生物承接染色质免疫沉淀(ChIP)实验等分子检测相关服务上万例,积累了大量的操作经验,还有超多的结果案例可供大家参考~还可以详细解析ChIP实验的标准化操作流程(SOP)、关键优化点及高级应用,确保实验可重复性和数据可靠性。
为大家详细分享ChIP 实验操作步骤,同时为广大科研工作者开展线上的理论培训与线下实操,可承接ChIP 实验外包服务。
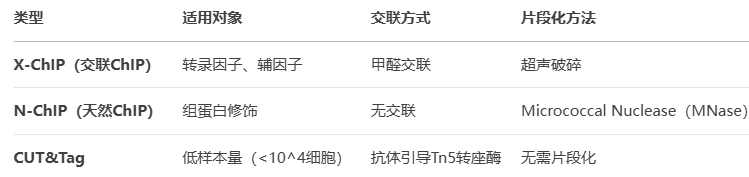
ChIP实验原理与分类
1. 基本原理
ChIP通过甲醛交联固定细胞内蛋白质-DNA复合物,超声或酶切破碎染色质,利用特异性抗体富集目标蛋白结合的DNA片段,最终通过PCR、qPCR或高通量测序(ChIP-seq)进行定性和定量分析。
2. ChIP技术分类
实验前准备
1. 关键试剂与设备
——细胞/组织样本:1×10^6–10^7细胞/ChIP
——交联试剂:37%甲醛(终浓度1%)、甘氨酸(终止液)
——裂解缓冲液:RIPA buffer(含蛋白酶抑制剂)
——抗体:ChIP级抗体(推荐Abcam、CST、Diagenode)
——磁珠:Protein A/G磁珠(Dynabeads®)
——片段化设备:Covaris超声仪(推荐S220/Sonicator 3000)
——DNA纯化试剂盒:Qiagen MinElute或Zymo DNA Clean & Concentrator
2. 抗体选择与验证
抗体特异性验证:WB或IP验证靶蛋白结合能力
ChIP适用性验证:查阅ENCODE数据库或已发表文献
对照设置:
●阳性对照:H3K27me3(异染色质)、H3K4me3(活跃启动子)
●阴性对照:IgG同型对照
●Input对照:1%未免疫沉淀染色质
更多案例查看可以点击普拉特泽《案例库》
标准ChIP实验流程
1. 细胞交联与染色质制备
甲醛交联:
细胞培养至80%汇合度,加入1%甲醛(终浓度),室温交联10min
加入125mM甘氨酸(终浓度)终止反应5min
细胞裂解:
预冷PBS洗涤2次
加入含蛋白酶抑制剂的RIPA缓冲液,冰上裂解10min
离心(4℃, 2000g, 5min)收集细胞核
2. 染色质片段化
A. 超声破碎(适用于X-ChIP)
推荐参数(Covaris S220):
峰值功率:75W
占空比:5%
循环次数:200次
目标片段大小:200–500bp(电泳验证)
B. MNase酶切(适用于N-ChIP)
37℃消化5–15min,EDTA终止反应
电泳检测单核小体(~147bp)
3. 免疫沉淀(IP)
预清除:加入Protein A/G磁珠,4℃孵育1h减少非特异性结合
抗体孵育:
取50–100μg染色质,加入1–5μg抗体,4℃旋转孵育过夜
磁珠结合:
加入Protein A/G磁珠,4℃孵育2h
洗涤步骤(严格去除非特异结合):
Low Salt Wash Buffer(1×)
High Salt Wash Buffer(1×)
LiCl Wash Buffer(1×)
TE Buffer(2×)
4. 交联逆转与DNA纯化
交联逆转:
加入Elution Buffer(1% SDS, 0.1M NaHCO₃),65℃孵育6h
蛋白酶消化:
加入RNase A(37℃ 30min)和Proteinase K(55℃ 1h)
DNA纯化:
使用MinElute柱纯化DNA,洗脱体积≤20μL
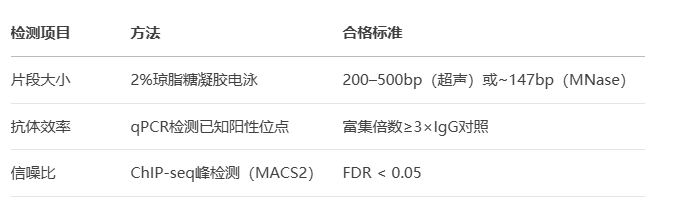
质量控制(QC)与数据分析
1. 关键QC指标
2. 下游分析技术
ChIP-qPCR:定量特定基因组位点(如启动子、增强子)
ChIP-seq:全基因组结合位点分析(推荐Illumina NovaSeq)
CUT&Tag:低样本量(500–50,000细胞)的高灵敏度替代方案
常见问题与优化策略

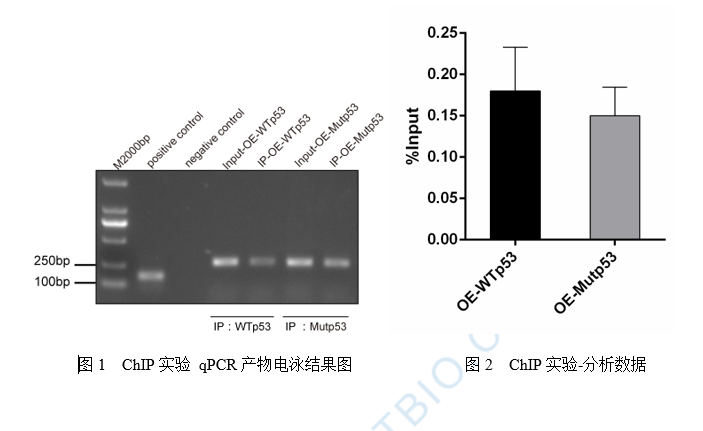
单细胞ChIP-seq(scChIP-seq):研究细胞异质性
CUT&RUN/CUT&Tag:无需交联,适用于珍贵样本
多组学整合分析:ChIP-seq + ATAC-seq + RNA-seq
ChIP实验的成功依赖于严格的实验设计、抗体选择和质控步骤。建议初次实验者采用阳性对照(如H3K27ac)优化条件,并结合ChIP-seq验证全局结合谱。随着技术进步,CUT&Tag等新方法正逐步替代传统ChIP,为低样本量研究提供更高灵敏度解决方案。
欲获得更多的信息和帮助,可通过以下方式联系:
流式检测|病理检测|动物模型|实验服务|分子操作|免疫相关检测
免费热线:18570028002

