

原代神经元/干细胞培养鉴定全攻略:突破特殊细胞培养瓶瓶颈
 2025-06-12 17:50:11
2025-06-12 17:50:11
来源/作者:普拉特泽-生物医学整体课题外包平台
本文就给小白们从简介原理分类方法细细讲讲,梳理夯实一下基础。
在神经退行性疾病研究与再生医学领域,原代神经元和干细胞培养是探索细胞机制、药物筛选及细胞治疗的基础技术。这类特殊细胞对培养环境极为敏感,操作不慎即导致分化异常或细胞死亡。普拉特泽生物将系统解析关键操作要点,
掌握核心操作要点,让脆弱神经细胞与多能干细胞在体外稳定生长,
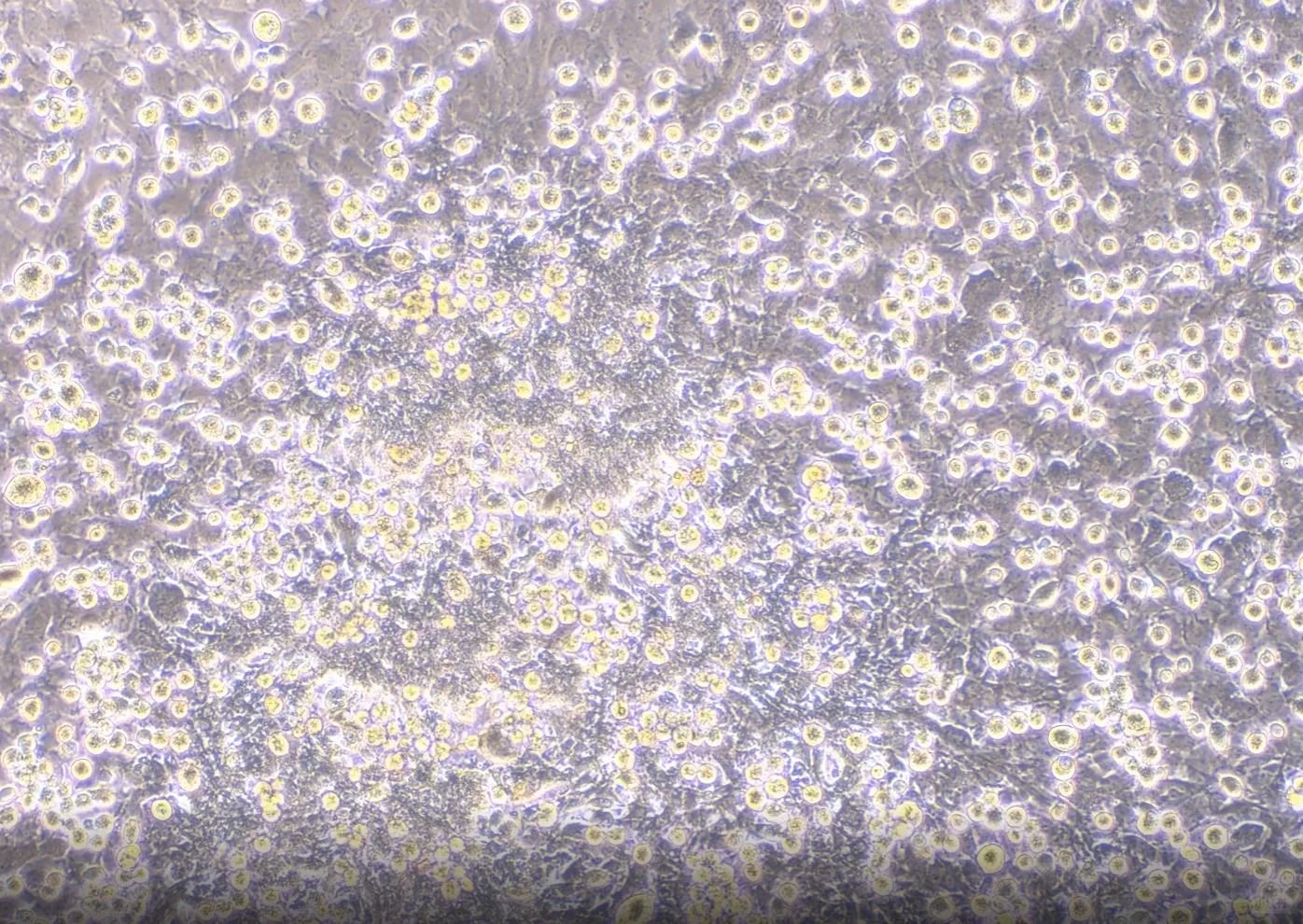
一、精细操作决定成败
▲取材与分离:时间就是生命
①时效性至上:取产后24小时内的新生鼠海马或皮层组织,低温保存勿超24小时。
②酶解优化:采用低浓度胰酶(0.125%) 消化15分钟,以胎牛血清紧急终止反应,避免过度损伤。
③机械分离技巧:用抛光巴斯德吸管轻柔吹打≤20次,保留细胞完整性。
▲纯化与接种:密度决定命运
●差速贴壁除杂:利用成纤维细胞更快贴壁特性(30-60分钟),转移未贴壁细胞至新瓶,显著提升神经元纯度。
●精准密度控制:接种密度≥5×10⁴ cells/cm²,确保神经突触网络形成;密度不足时神经元易凋亡。
●培养环境定制:模拟体内微环境
●包被基质选择:多聚赖氨酸(0.1mg/ml)或鼠尾胶原包被培养皿,提供神经元贴壁“锚点”。
●血清替代方案:Neurobasal/B27无血清培养基抑制胶质细胞增殖,维持神经元纯度>90%。
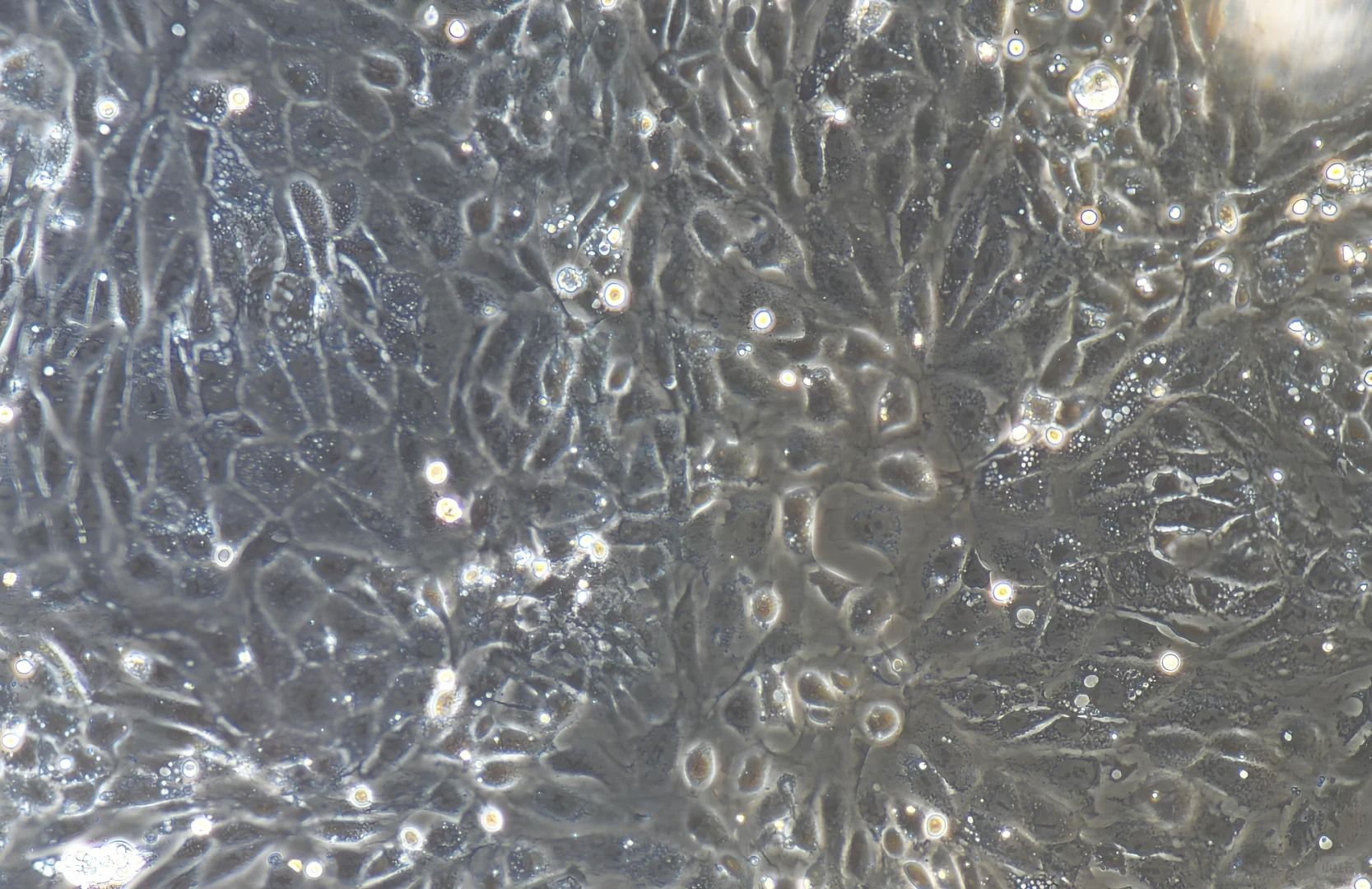
二、干细胞培养
干性维持与防分化
▲胚胎干细胞(ESCs):需饲养层细胞(如经照射的STO成纤维细胞)提供生长支持,添加白血病抑制因子(LIF) 抑制自发分化。
▲间充质干细胞(MSCs):采用低血清培养基(5%FBS),添加bFGF(10ng/ml)促进增殖同时抑制分化。
▲神经干细胞(NSCs):悬浮培养形成神经球,培养基需含EGF/bFGF双因子,每3天半量换液维持因子浓度。
传代操作关键点
酶消化替代方案:推荐使用温和消化酶(如Accutase) 替代胰酶,减少膜蛋白损伤。
神经球机械分散:避免酶消化损伤,用火焰抛光的玻璃吸管轻柔吹散神经球。
表:神经元与干细胞培养条件关键对比

三、从形态到功能的金标准
▲形态学初判
神经元:培养7天后伸出细长突起,形成网状连接。
NSCs:原代培养24小时形成2-4细胞神经球,Nestin免疫荧光阳性。
▲免疫表型鉴定
神经元标志物:βIII-tubulin(早期)、MAP2(成熟神经元)、Synaptophysin(突触形成)。
干细胞干性标志:
ESCs:OCT4+/SSEA-4+(人)、SSEA-1+(鼠)
MSCs:CD90+/CD44+/CD34- 3
功能验证
电生理检测:诱导分化21天后神经元应产生动作电位。
多向分化潜能:MSCs经成骨/成脂诱导后,分别以茜素红/油红O染色验证。
四、实战问题破解:高频失误纠正方案
▲细胞贴壁失败
根源:包被不足或血清含量低
对策:胶原包被(0.1mg/ml),接种后静置3-5小时再补液
▲神经球分化率低
根源:生长因子缓释不足
创新方案:采用壳聚糖纳米载体负载NGF,缓释72小时,分化效率提升至78.3%(传统法仅41.2%)
干细胞早衰
▲根源:传代过度或密度不当
黄金标准:贴壁达90%即传代,接种密度保持1×10⁵ cells/cm²17
培养基更换后漂浮细胞增多
温度休克预防:培养基必须预热至37℃,避免冷刺激致细胞收缩脱落
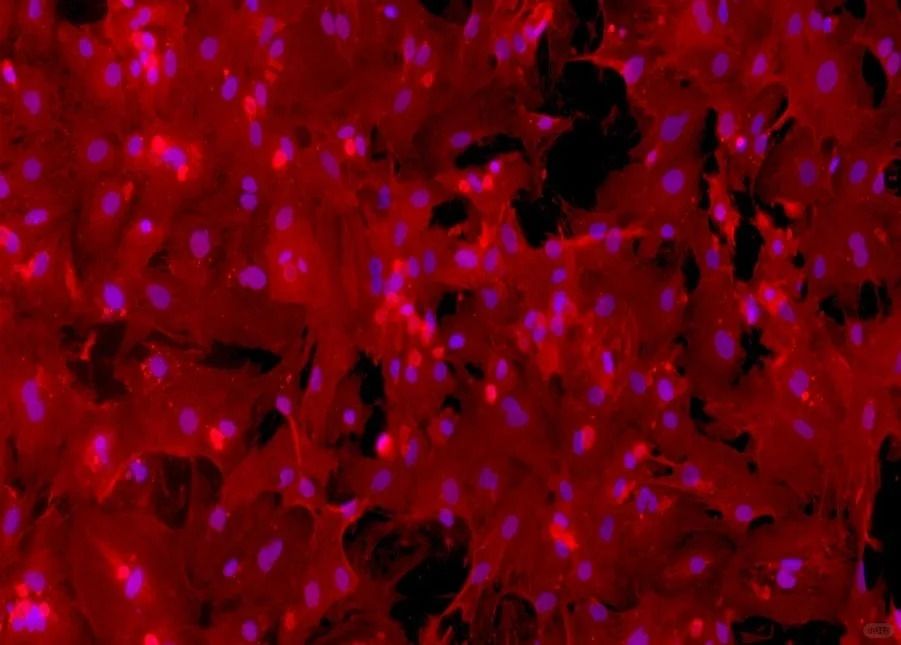
五、提升培养效率
壳聚糖-NGF纳米颗粒:粒径147nm的缓释系统,结合BDNF构建诱导体系,显著提升ADMSCs向功能性神经元分化效率。
无血清培养基革新:避免动物源成分,添加人源血小板生长因子(hPDGF),降低批间差并支持临床应用。
原代神经元与干细胞培养的成功,建立在三大基石之上:严格的时间控制(取材至接种的时效)、精确的微环境模拟(生长因子组合及基质包被),以及规范的无菌操作。
每一步操作的精细度,直接决定了细胞状态与实验数据的可靠性。
随着缓释载体技术与无血清培养基的迭代,未来这些特殊细胞的培养将逐步突破效率瓶颈,为神经再生与器官构建研究提供更强大的技术支撑。
普拉特泽,坚持提供真实、完整、唯一原始数据、原始图片。
普拉特泽生物,自有专业动物房、造模实验室,配套设备齐全,技术团队成熟,熟练掌握各类动物模型构建,更有细胞、分子、病理平台,一站式解决后续相关实验检测。请点击细胞实验平台了解详情,或者直接扫码↓↓↓

