

脓毒症动物模型实验注意事项
 2025-05-08 17:00:29
2025-05-08 17:00:29
来源/作者:普拉特泽-生物医学整体课题外包平台
脓毒症(Sepsis)是临床常见的危重症,其病理机制复杂,涉及全身炎症反应、免疫失衡及多器官功能障碍,构建可靠的动物模型是研究脓毒症发病机制和药物疗效的关键~普拉特泽生物动物实验平台专业承接脓毒症模型、裸鼠成瘤实验外包、肝纤维化等动物实验代做服务,积累专业丰富的实验操作经验。上期我们分享脓毒症动物模型实验常见问题与解决方案大家都说不够详细,实验过程中操作不当、模型选择错误或术后管理疏漏均可能导致实验失败。那今天咱们就为大家专门出一期基于最新研究与实践经验,总结脓毒症动物模型实验的核心注意事项,帮助科研人员规避风险、提升实验成功率
一、模型选择:CLP vs LPS,如何科学决策?
脓毒症动物模型主要包括盲肠结扎穿孔(CLP)模型和脂多糖(LPS)诱导模型,两者各有优劣(表1):
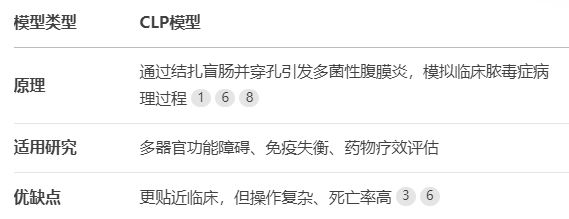
模型类型 CLP模型 LPS模型
原理 通过结扎盲肠并穿孔引发多菌性腹膜炎,模拟临床脓毒症病理过程168 腹腔注射LPS(内毒素)激活全身炎症反应,操作简便28
适用研究 多器官功能障碍、免疫失衡、药物疗效评估 急性炎症反应、细胞因子风暴机制研究
优缺点 更贴近临床,但操作复杂、死亡率高36 重复性好、成本低,但难以模拟脓毒症晚期免疫抑制

选择建议:
CLP模型:适用于需要模拟临床多菌性感染及器官衰竭的研究,需重点关注结扎长度(如结扎50%-60%盲肠可诱导中度脓毒症)和穿孔针规格(19G针头增加死亡率)。
LPS模型:适合快速筛选抗炎药物,需根据动物品系调整剂量(如C57BL/6小鼠常用5-10 mg/kg)
二、实验操作中的“致命细节”
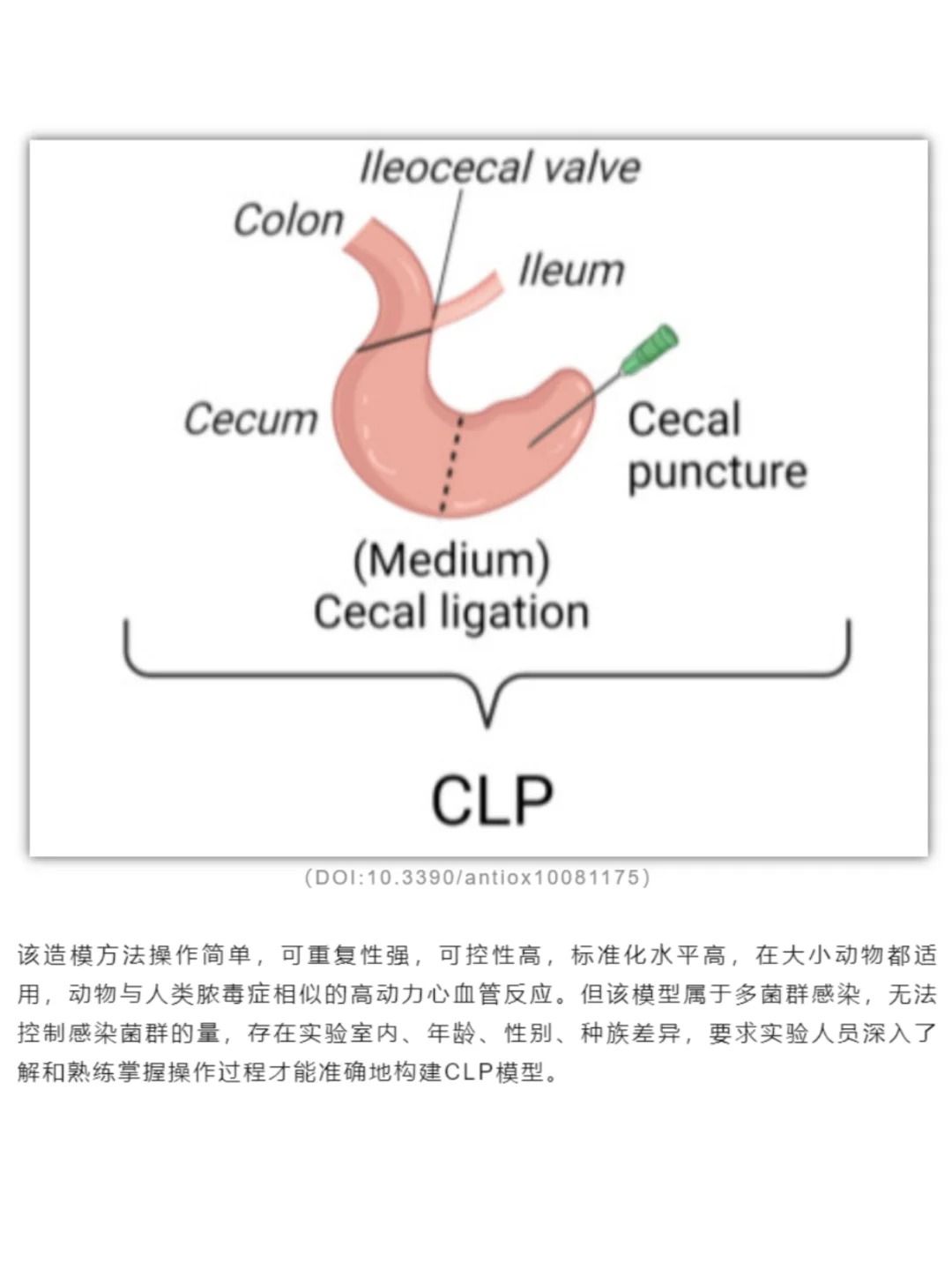
1. CLP模型操作要点
麻醉与无菌:推荐使用异氟烷或戊巴比妥钠麻醉,避免麻醉过深导致术中死亡。手术器械需高温灭菌,术区剃毛后用碘伏消毒,降低感染风险。
盲肠处理:
①结扎位置需避开回盲瓣,保持肠道连续性。
②穿孔后轻挤盲肠排出少量粪便(约1滴),确保穿孔通畅但避免过度污染腹腔。
③缝合与复苏:采用4-0可吸收缝线分层缝合腹膜及皮肤,术后立即腹腔注射预热生理盐水(50 mL/kg)并放置于37℃温垫复苏。
2. LPS模型关键参数
①剂量控制:过高剂量(如>20 mg/kg)易致急性死亡,建议预实验确定最佳剂量。
②注射方式:腹腔注射需避开脏器,避免直接损伤;静脉注射适用于快速诱导全身反应。
三、术后管理:决定模型稳定性的隐形因素
□镇痛与补液
CLP术后24小时内皮下注射丁丙诺啡(0.05 mg/kg)缓解疼痛,减少应激反应。
每日补充5%葡萄糖盐水(1-2 mL/只),维持水电解质平衡。
□环境控制
保持温度(25±1℃)和湿度(50%-60%),使用无尘垫料减少感染风险。
单独饲养术后动物,避免同类攻击导致伤口裂开。
□监测指标
①生存率:CLP模型需记录48小时存活率(中度脓毒症约50%-60%)。
②生理指标:体温(脓毒症早期常升高,晚期降低)、呼吸频率(>150次/分钟提示呼吸窘迫)。
③行为学评分:采用小鼠脓毒症评分(MSS),评估竖毛、活动度、眼分泌物等。

四、数据验证:从表型到机制的全面分析
▲生化与炎症指标
→血液检测:白细胞计数(WBC)、中性粒细胞/淋巴细胞比值(NLR)、CRP、PCT2。
→细胞因子:ELISA检测TNF-α、IL-6、IL-10水平,反映炎症与免疫抑制状态。
▲组织病理学
→肝、肾、肺组织HE染色,观察炎性细胞浸润、水肿及坏死。
→免疫组化检测器官中NF-κB、HMGB1等炎症通路标志物表达。
▲模型验证标准
→CLP模型:术后12小时出现菌血症,18-24小时死亡率显著上升。
→LPS模型:注射后6小时血清TNF-α达峰值,24小时IL-6持续升高。
五、伦理与可重复性:不可忽视的科研底线
伦理规范
→遵循3R原则(替代、减少、优化),术前通过动物伦理委员会审批。
→采用二氧化碳安乐死,避免不必要的痛苦8。
可重复性保障
→详细记录操作参数(如结扎盲肠长度、针头型号、LPS批号)。
→设立假手术组(仅开腹不结扎)和阳性对照组(如地塞米松干预),确保数据可比性。
结语
构建脓毒症动物模型是一项高度精细的工作,从模型选择到数据验证的每个环节均需严格把控。CLP模型虽操作复杂,但更贴近临床;LPS模型则适用于机制初探。
通过优化术后管理、规范数据采集,并结合多维度验证,可显著提升实验的可靠性与论文发表价值
如果你总是在做实验时总会遇上这样那样的问题需要帮助时,请记得在脓毒症动物模型实验中遇到技术问题可添加技术微信:18570028002
我司还提供脓毒症动物模型实验外包服务或实验培训

