

脑缺血动物模型构建实验注意事项
 2025-04-27 16:42:44
2025-04-27 16:42:44
来源/作者:普拉特泽-生物医学整体课题外包平台
脑缺血动物模型是研究脑卒中病理机制和药物开发的重要工具,在神经科学研究领域具有不可替代的价值,构建稳定可靠的脑缺血模型
由普拉特泽生物为大家总结分享,普拉特泽生物动物实验平台专业承接裸鼠成瘤实验外包、动物造模等动物实验代做服务,积累专业丰富的实验操作经验。上期我们分享标准化操作流程与常见问题解析后大家都说不够详细,有一些注意事项没有写出来,那今天咱们就为大家专门出一期脑缺血动物模型构建的实验注意事项,帮助研究人员规避常见问题,提高实验成功率。
一、脑缺血动物模型选择注意事项
1. 模型类型选择
①脑缺血动物模型主要分为全脑缺血模型和局灶性脑缺血模型两大类:
②全脑缺血模型:适用于研究心脏骤停后全脑缺血损伤
③局灶性脑缺血模型:更接近人类缺血性卒中病理过程
局灶性脑缺血模型又可分为:
⒈永久性大脑中动脉闭塞模型(pMCAO)
⒉短暂性大脑中动脉闭塞模型(tMCAO)
2. 动物选择考量
㈠大鼠:最常用,尤其是SD和Wistar大鼠
㈡小鼠:适合基因修饰研究,但手术难度较大
㈢年龄与体重:成年动物(大鼠250-300g,小鼠20-30g)结果更稳定
㈣性别差异:雌性动物对缺血更耐受,建议单一性别研究

二、手术操作关键注意事项
1. 术前准备
动物适应性饲养:至少3天,减少应激反应
禁食处理:手术前禁食6-12小时(不禁水)
麻醉选择:异氟烷吸入麻醉为首选,易于控制麻醉深度
体温维持:手术全程维持动物体温37±0.5℃
2. 手术过程要点
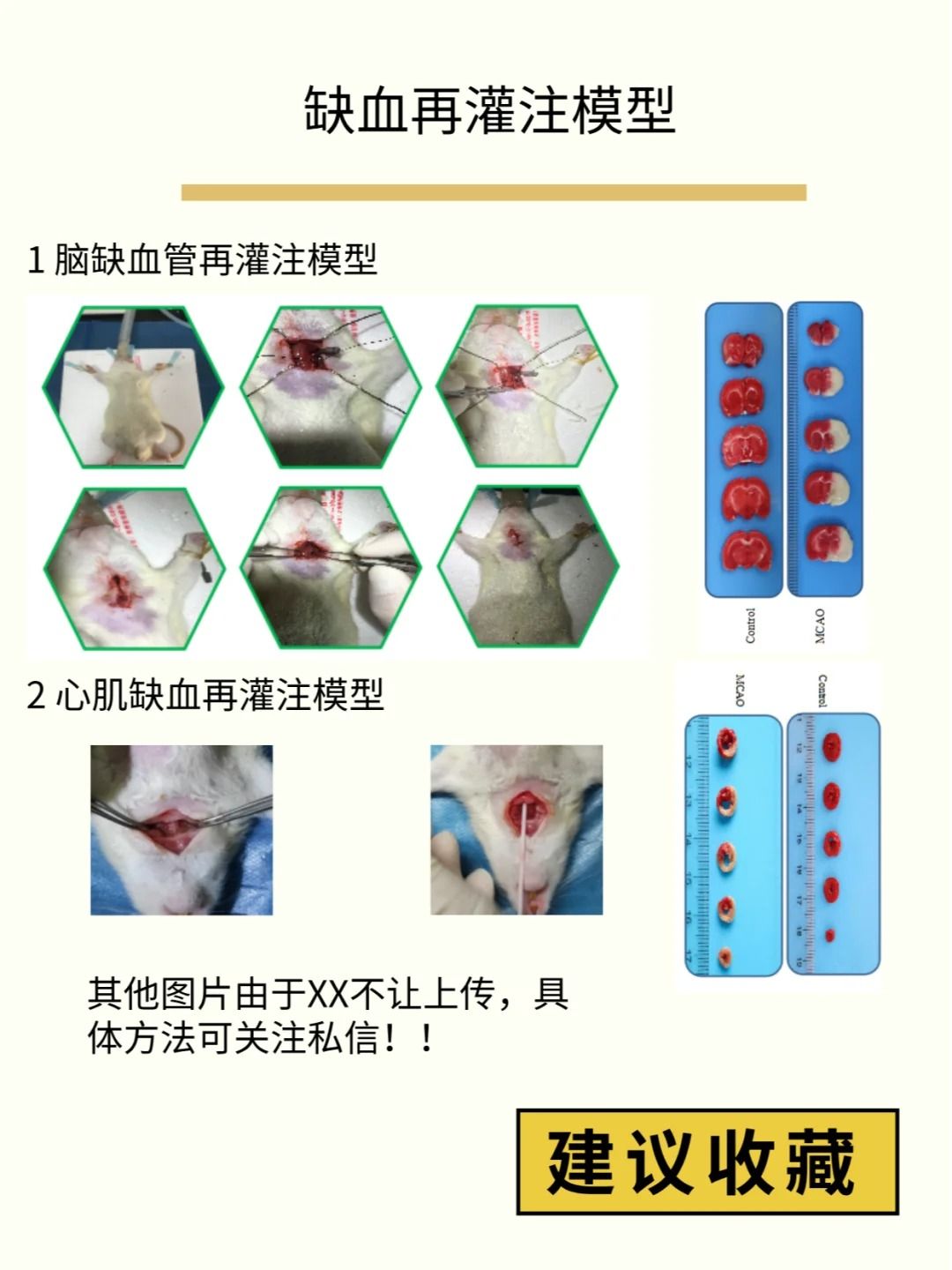
线栓法MCAO模型关键技术点:
⑴颈动脉分离:
避免过度牵拉迷走神经
小心处理颈动脉分叉处的舌咽神经
⑵线栓插入:
选择合适的线栓直径(大鼠0.28-0.30mm,小鼠0.18-0.22mm)
硅胶涂层线栓可减少血管损伤
插入深度:大鼠18-22mm,小鼠10-12mm
⑶缺血时间控制:
tMCAO通常60-90分钟
精确计时,使用激光多普勒监测更佳
3. 术后护理
①恢复期保温:直至动物完全清醒
②疼痛管理:适当使用镇痛药物
③营养支持:提供易获取的食物和饮水
④神经功能评估:24小时内定期观察
三、质量控制关键指标
1. 手术成功率评估
神经功能评分:采用标准化量表如Longa评分
脑血流监测:激光多普勒血流仪确认血流下降>70%
TTC染色:确认梗死体积
2. 排除标准
术中死亡:通常<10%
蛛网膜下腔出血:立即排除
神经功能评分异常:如旋转>4圈/分钟
四、常见问题解决方案
1. 高死亡率处理
优化麻醉深度
提高手术熟练度
使用更细的线栓
2. 梗死体积变异大
标准化线栓插入深度
控制动物体重范围
使用相同批次的线栓
3. 模型不稳定性
保持环境条件恒定
固定手术人员
建立标准操作流程(SOP)
五、伦理与替代方法考量
⑴3R原则应用:
减少动物数量
优化实验设计
寻求替代方法
⑵人道终点设定:
明确实验终止标准
减轻动物痛苦
⑶替代模型评估:
体外缺氧模型
器官芯片技术
计算机模拟
构建稳定可靠的脑缺血动物模型需要严格把控各个环节,从模型选择、手术操作到术后评估都需标准化。遵循上述注意事项可显著提高实验成功率,获得可靠的研究数据。
随着技术进步,脑缺血模型的构建方法将不断优化,为脑卒中研究提供更精准的工具。
如果想知道更多的关于脑缺血动物模型构建的相关案例和知识点,以及专属研究方法,也可以联系我们:18570028002 或 微信 pulateze666会把这些资料发送给大家哦【还可以直接进交流群学习、师姐进行解答】

