

细胞侵袭实验基质胶使用全指南:浓度选择、铺板技巧与常见问题解析
 2025-05-26 16:10:53
2025-05-26 16:10:53
来源/作者:普拉特泽-生物医学整体课题外包平台
细胞侵袭实验基质胶使用全指南由普拉特泽生物细胞检测平台总结分享,细胞检测平台为广大科研实验人员提供细胞侵袭实验服务,
在细胞侵袭实验(如Transwell)中,基质胶(Matrigel)的规范使用是实验成功的关键。错误的浓度选择或铺胶不均可能导致数据偏差甚至失败。本文基于《Nature Protocols》标准及实验室实战经验,详解基质胶的使用方法,助大家轻松掌握操作要点!
一、基质胶的作用与选择
1. 基质胶的核心功能
模拟体内微环境:提供层粘连蛋白、胶原等成分,模拟细胞外基质(ECM)。
评估侵袭能力:细胞需分泌蛋白酶(如MMPs)降解基质才能迁移,量化穿透率反映侵袭活性。
2. 基质胶类型推荐
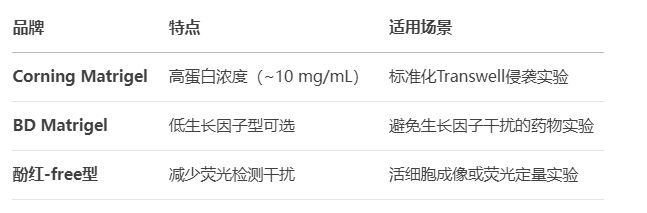
二、基质胶浓度选择与稀释方法
1. 浓度选择依据
细胞侵袭性强弱:
▲高侵袭细胞(如MDA-MB-231):薄胶(5-10 μg/μL,约1:8稀释)。
▲低侵袭细胞(如MCF-7):厚胶(20 μg/μL,约1:4稀释)。
实验目的:
▲初筛实验:统一使用10 μg/μL(平衡灵敏度与通量)。
▲机制研究:梯度测试(5/10/20 μg/μL)分析基质密度影响。
2. 稀释步骤(以Corning Matrigel为例)
解冻:4℃过夜缓慢融化,避免反复冻融。
预冷耗材:枪头、离心管冰上预冷30分钟。
稀释计算:
\text{稀释体积} = \frac{\text{原液浓度} \times \text{原液体积}}{\text{目标浓度}} - \text{原液体积}
示例:将10 mg/mL原液稀释至10 μg/μL,需按1:9稀释(如50 μL原液+450 μL预冷无血清培养基)
混匀:轻柔吹打(避免气泡),冰上操作防止凝固。
三、基质胶铺板标准化流程
1. Transwell小室预处理
▲平衡温度:将Transwell板置于室温10分钟,减少膜表面张力。
▲湿润膜孔:加入50 μL无血清培养基,37℃孵育30分钟,吸弃液体。
2. 铺胶操作
加胶体积:根据膜面积调整(常用24孔板小室加50 μL)。
均匀铺胶:
枪头垂直悬空,缓慢滴加至膜中央,靠液体张力自然铺展。
禁止触碰膜表面(避免破损)。
凝固条件:37℃孵育1小时,形成均一胶层。
关键技巧:
冰上操作:全程保持基质胶4℃以下,防止提前凝固。
避免气泡:枪头贴壁缓慢加样,若有气泡用预冷枪头轻轻戳破。
四、5大常见问题与解决方案
1. 胶层不均匀或破裂
原因:枪头触碰膜面、温度波动导致局部凝固。
解决:弃用该小室,重新铺胶;确保操作全程低温。
2. 细胞无法穿透基质胶
可能原因:
▲胶浓度过高 → 降低至5 μg/μL测试。
▲细胞活性不足 → 检测细胞存活率(台盼蓝染色≥95%)。
验证方法:设置无基质胶的迁移实验对照。
3. 背景噪音高(非特异性穿透)
▲原因:铺胶量不足或胶层有裂隙。
▲解决:增加铺胶体积至60-70 μL,孵育后显微镜检查胶层完整性。
4. 基质胶不凝固
原因:
▲稀释液含血清 → 使用无血清培养基稀释。
▲孵育温度不足 → 确认培养箱温度稳定在37℃±0.5℃。
5. 批次间数据差异大
对策:
▲新批次基质胶预实验(与旧批次平行比较)。
▲使用同一品牌及货号产品,记录批号。
五、数据解读与优化建议
1. 穿透率计算
\text{穿透率} = \frac{\text{下室细胞数}}{\text{接种细胞数}} \times 100\%
参考范围:
高侵袭细胞:20%-50%(如HT-1080纤维肉瘤细胞)。
低侵袭细胞:<5%(如正常成纤维细胞)。
2. 侵袭指数校正
\text{侵袭指数} = \frac{\text{含胶穿透率}}{\text{无胶穿透率}}
阈值:侵袭指数>2表示显著侵袭能力。
六、试剂与工具推荐
1. 必备工具
①预冷枪头:避免胶体提前凝固(推荐Corning CoolBox)。
②无菌镊子:转移Transwell小室,避免手部接触。
2. 替代方案
①人工基质胶:Collagen I(3 mg/mL)模拟基底膜,成本更低。
②荧光定量法:Calcein-AM染色替代结晶紫,减少计数误差。
欲获得更多的信息和帮助,可通过以下方式联系:
普拉特泽生物科技有限公司
流式检测|病理检测|动物模型|实验服务|分子操作|免疫相关检测
免费热线:18570028002
