

同样是蛋白电泳,SDS-PAGE和PAGE到底有啥不一样?
 2025-08-07 17:27:48
2025-08-07 17:27:48
来源/作者:普拉特泽-生物医学整体课题外包平台
Question:同样是蛋白电泳,SDS-PAGE和PAGE到底有啥不一样?(普拉特泽生物提供长期稳定的分子实验外包服务)
答:SDS-PAGE 毫无疑问是 PAGE 的升级版,二者都是常用的电泳分离技术,尤其是 SDS-PAGE更为常用,几乎是 WB 实验的标配;而 PAGE(或强调为NativePAGE)相比之下在蛋白质实验中较少用到。
在这篇文章中,我们将讨论几个问题:
SDS-PAGE与原版PAGE在原理与应用范围上有什么区别?
为什么WesternBlot实验需要用SDS-PAGE?
Native PAGE适用于什么情形?
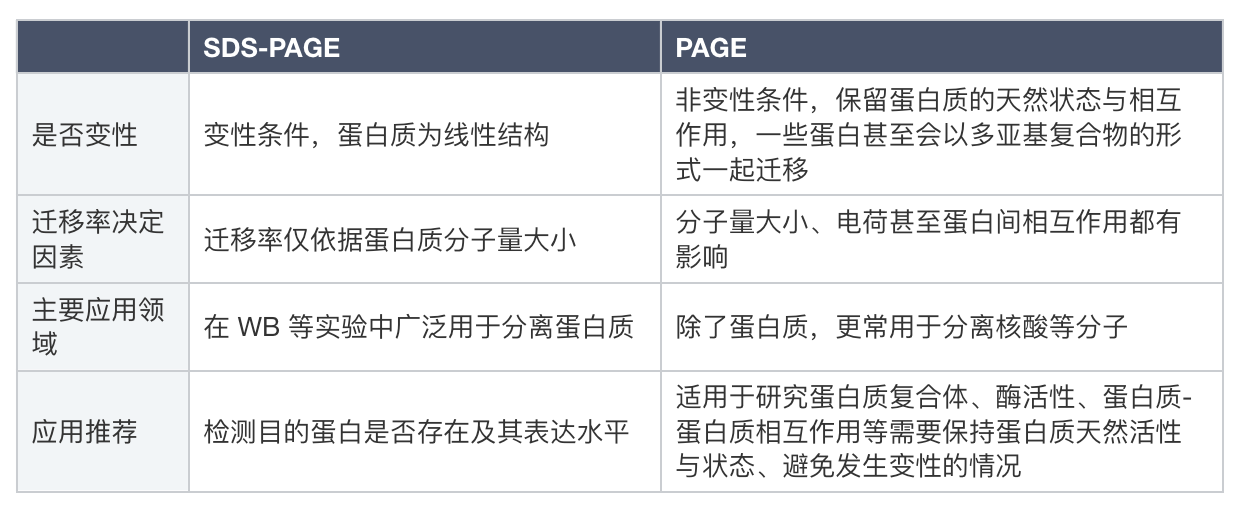
简单来说,首先发明出的PAGE是基础版,这个基础版的原理就是分子筛+电场。作为一个分离工具,用它跑什么分子都可以。但由于分离蛋白的需求,加上蛋白质分子的特性,为了在蛋白实验中加强蛋白质的分离效果,于是就有人想到在样本与缓冲液中额外加入SDS使蛋白质变性,使蛋白质分子在电泳过程中仅依据分子量大小进行分离,这就是SDS-PAGE。
它们的核心区别毫无疑问在于是否加入SDS(十二烷基硫酸钠),这是一种离子型去垢剂,通过破坏蛋白质中的非共价键使之变性,从三维构象变成线性结构,这个过程通常被称为蛋白质线性化。另一方面,SDS与蛋白质结合后形成复合物,通过赋予蛋白质大量负电荷来掩盖蛋白质本身表面携带的电荷,使其在电泳时的迁移率仅由分子量大小决定,而不受其原始电荷或形状的影响。
WB一般都使用SDS-PAGE分离蛋白质,原因有以下几点:
1. 抗体识别线性表位:由于许多抗体只能识别蛋白质的线性表位,需要通过SDS-PAGE将蛋白质线性化,使其抗体表位暴露在外,以便抗体结合。
2. 分子量测定:变性后的蛋白质在电场中的迁移率仅与分子量有关,可以用Marker测量,从而准确估计目标蛋白的分子量。
3. 稳定性:变性过程破坏了蛋白的活性,避免发生反应,蛋白理论上性质更稳定一些。
4. 避免蛋白质聚集:变性过程破坏非共价相互作用,避免蛋白质聚集或形成复合物。跑WB为了后期抗体结合出清晰的条带,需要让样本中的蛋白质混合物分离成清晰的一个一个的分子;一旦发生聚集,条带就不准确了。
原生版的PAGE是非变性的(NativePAGE),不加入SDS等变性剂,因此它最大的特点就是保留了蛋白质的活性。如果说SDS-PAGE是为了通过变性加强蛋白分离效果的魔改版,那么现在也有针对让PAGE保留蛋白活性的魔改升级版,如BN-PAGE。
针对PAGE非变性这一特点,它更适合应用在以下领域:
1. 需保持蛋白质活性的情况:由于是非变性条件,蛋白质保持其高级结构,因此其生物活性也得到保留。如果此时电泳仅作分离,后续还要继续研究如酶活性、配体结合能力以及其他需要保留原本功能的情况,就需要选择非变性的PAGE进行分离。
2. 分析蛋白质聚集体或蛋白质-蛋白质相互作用:NativePAGE可以用于分析蛋白质复合物。由于保留了蛋白间的相互作用,因此某些蛋白质也可能会以多亚基复合物的形式一起迁移,并以不可预测的方式移动。这种复合物常表现为弥散状条带,而非通常所见的清晰的条带。
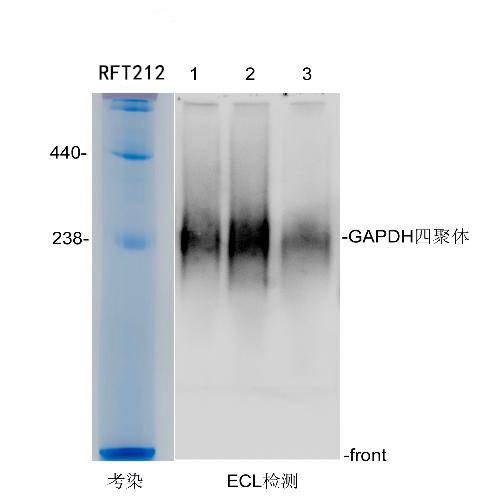
文源自实验室老司机
今天关于SDS-PAGE和PAGE就分享到这儿啦~如果您在实验过程中遇到技术问题,或者需要实验外包和代做,可与我们技术老师联系18570028002(微信同号)

