

【跟着文献搞课题】之谷氨酰胺代谢(这个方向冷门!)
 2023-05-26 14:24:30
2023-05-26 14:24:30
来源/作者:普拉特泽-生物医学整体课题外包平台
上两期我们给大家介绍了“有氧糖酵解”。从今天开始,我们继续给大家介绍一个相关联的代谢类型“谷氨酰胺代谢”~
首先,什么是谷氨酰胺代谢?
除了前面提过的糖代谢、脂质代谢以外,谷氨酰胺代谢也同样是细胞中一种重要的代谢方式。
谷氨酰胺代谢最早发现是在肿瘤细胞中,由于糖酵解取代其他途径,成为了细胞分解葡萄糖供能的首选方法。葡萄糖转化为乙酰辅酶A (Acetyl-CoA)进入三羧酸循环的过程被阻断。肿瘤细胞转而加速提高了细胞内的谷氨酰胺代谢水平,以维持细胞内的生物合成水平。
也因为和糖酵解途径的关联关系,谷氨酰胺代谢目前可以做单独的研究,也可以和糖酵解联合起来一起研究。
·目前的SCI发表及国自然课题的立项情况
这次和脂质代谢、糖酵解有些不同。虽然谷氨酰胺代谢研究也在各类疾病中都有所涉及(仍以肿瘤为主),且近年的报道数量也呈现上升趋势。BUT!谷氨酰胺代谢研究整体上看,无论是SCI报道量还是国自然的立项数量,都还非常少。
Glutaminolysis(谷氨酰胺代谢):
那么老问题又来了,要是真做起来,要怎么下手呢?答案呢,嗯,也是老答案,每一个代谢方式,都有较为清晰的主要通路及各环节上的标志物。利用好这些标志物,就可以往上引入非编码RNA类、转录因子、表观遗传等研究内容。
另外也是因为谷氨酰胺代谢这个内容研究的很少很少,所以熊汉三发现即使是近年的高分,这类研究中“找出谷氨酰胺代谢参与疾病”本身就是内容最大的创新点所在。对于机制通路的新颖性、研究丰度要求倒也并不很高的说。
比如今天介绍的这篇SCI ~
这篇文献的题目是:
EGFR activates GDH1 transcription to promote glutamine metabolism through MEK/ERK/ELK1 pathway in glioblastoma
这篇是2020年1月刚刚热乎录用在Oncogene(最新IF=7.971)上的一篇关于谷氨酰胺参与调控胶质瘤的作用研究。
之前说了,从现在的研究进展来看,研究谷氨酰胺代谢本身往往就是一篇文章最大的创新点了。所以这篇文章入手选择的是一个在肿瘤中相对经典的明星基因EGFR,EGFR对肿瘤的调控作用很多。但EGFR通过谷氨酰胺代谢调控胶质瘤的作用机制,目前尚无报道。而这成为了课题组的入手方向~
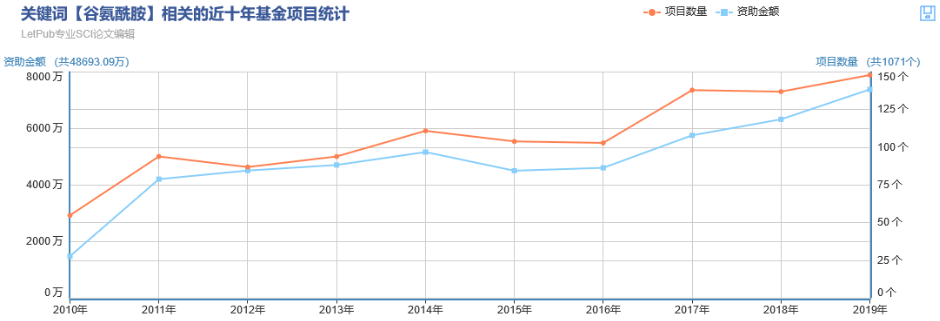
① 首先,先确认EGFR对谷氨酰胺代谢是有作用的(压根儿没作用的话还玩个锤子……):
检测不同浓度、不同刺激时间的EGF(用来激活EGFR)对谷氨酰胺代谢的标志产物α-KG(Fig 1A),NAPDH(Fig 1B), GSH(Fig 1C)含量的影响。发现EGF刺激(=EGFR激活)可以提高谷氨酰胺代谢水平。
② 然后找EGFR调控谷氨酰胺代谢的具体靶点:这里挑出来了9个谷氨酰胺代谢各环节的标志物,加入不同浓度、不同刺激时间的EGF(用来激活EGFR),发现只有GDH1的表达变化最为明显(Q-PCR,Fig 1D),其余几个标志物变化不明显(补充材料)
顺便再用同位素标记法确认一下GDH1参与谷氨酰胺代谢的环节。作为一个glutamate 向α-KG转化的调节蛋白,GDH1的沉默,可以对上游的glutamate含量没有影响,但可以明显抑制下游α-KG及其下游代谢产物的含量(Fig 1E)。于是确认:参与谷氨酰胺代谢的GDH1是EGFR调控谷氨酰胺代谢的靶点。
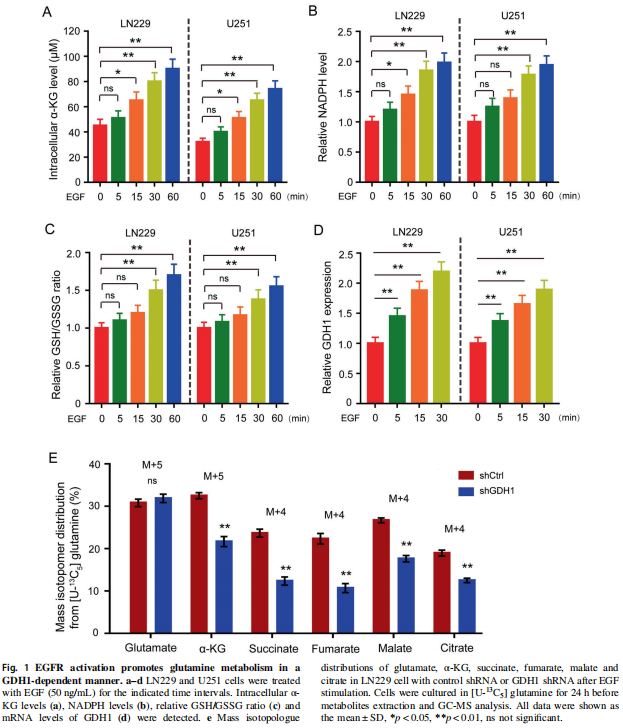
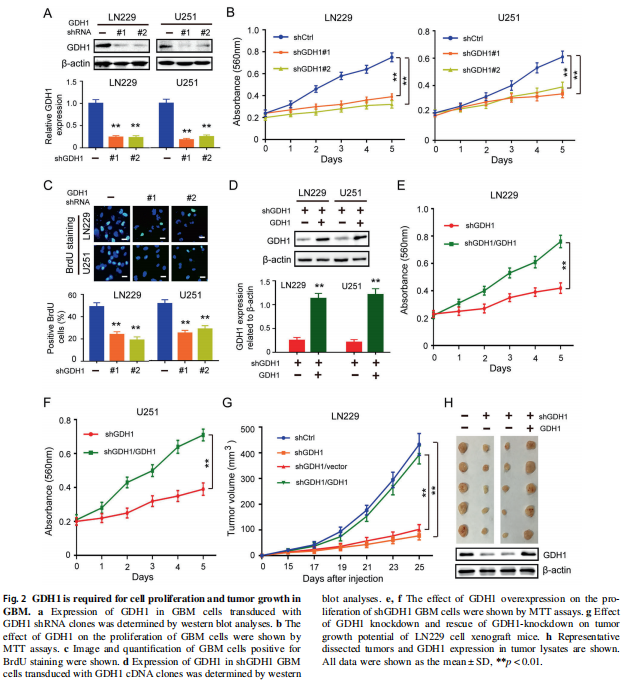
① 因为EGFR调控胶质瘤表型的作用已经很明确了。所以这里直接从GDH1下手。先确认GDH1是有作用的(GDH1对胶质瘤并没有作用的话,表达变化再大,也没有锤子玩……):
细胞水平:用shRNA抑制细胞内GDH1的表达,用WB验证表达效率,确认干扰效果(Fig 2A)。并发现,有效干扰下调GDH1的表达后,胶质瘤细胞的增殖活力(Fig 2B-MTT; Fig 2C-BrdU染色)受到了明显抑制。而下调GDH1的同时再次对GDH1做过表达(效果验证,Fig 2D),可以回复细胞的增值活力(Fig 2E、F)
动物水平:同样,下调GDH1的表达可以抑制移植瘤的生长,再次对GDH1做过表达后,可以“回复”肿瘤的生长。(Fig 2G、H)。
可得:GDH1可以促进胶质瘤的增殖。
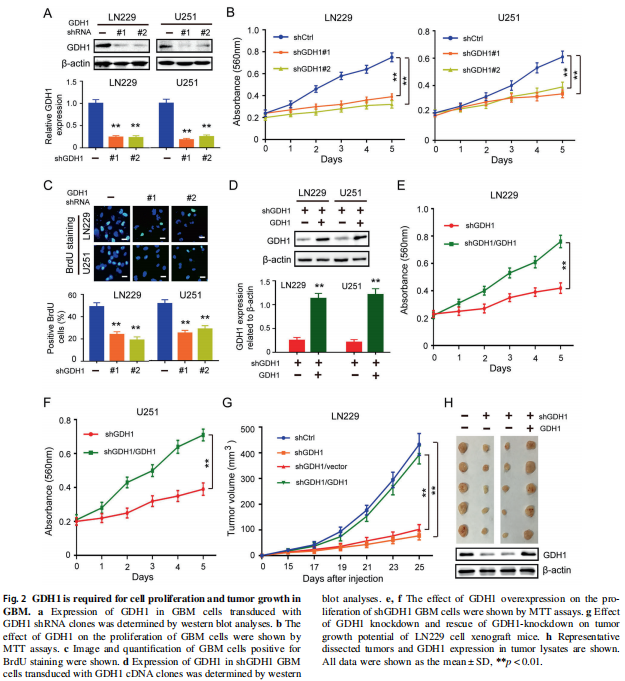
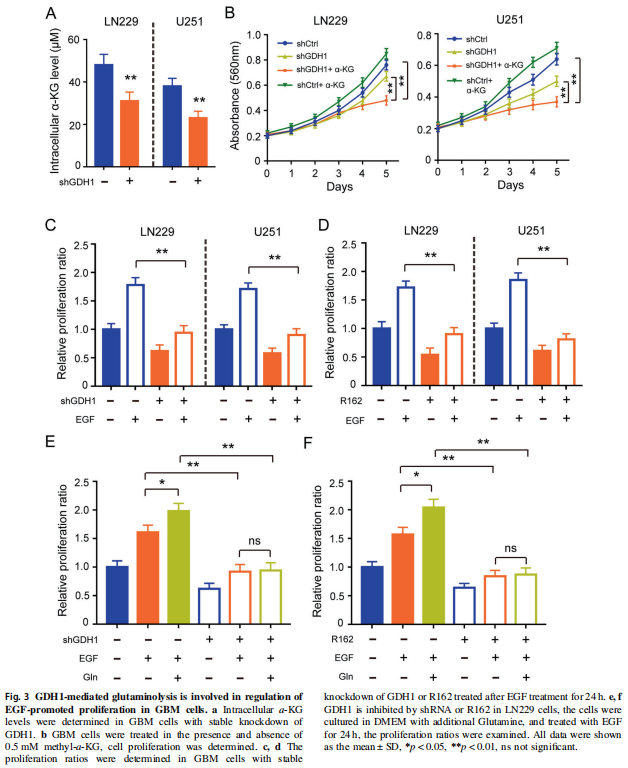
② 确认GDH-1通过谷氨酰胺代谢途径调控胶质瘤(回复实验)
上面我们介绍过,GDH1是调节一个glutamate 向α-KG转化的功能蛋白。所以首先确认一下GDH1沉默可以引起细胞内α-KG的含量降低(Fig 3A)。且外源α-KG的加入,可以逆转sh-GDH1对细胞增殖的抑制作用(MTT, Fig 3B)。先确认了GDH1通过谷氨酰胺代谢途径调控胶质瘤的增殖。
外源EGF(=EGFR激活)可以引起胶质瘤细胞的增殖活力的升高,而同时对GDH1进行表达沉默(sh-GDH1) 或者活性抑制(R162),可以逆转EGF/EGFR对胶质瘤细胞的增殖活力的促进作用(Fig 3C、D)。同时给予高浓度的谷氨酸(重新激活谷氨酰胺代谢通路),则可以再次逆转GDH1抑制 引起的细胞增殖活力下降(Fig 3E、F)。说明,EGFR可以通过GDH1/谷氨酰胺代谢途径,调控胶质瘤的增殖。
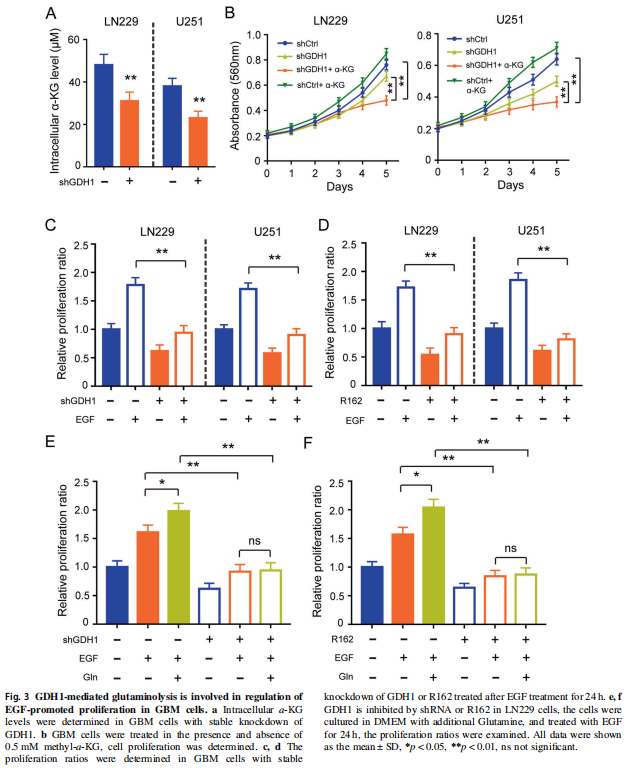
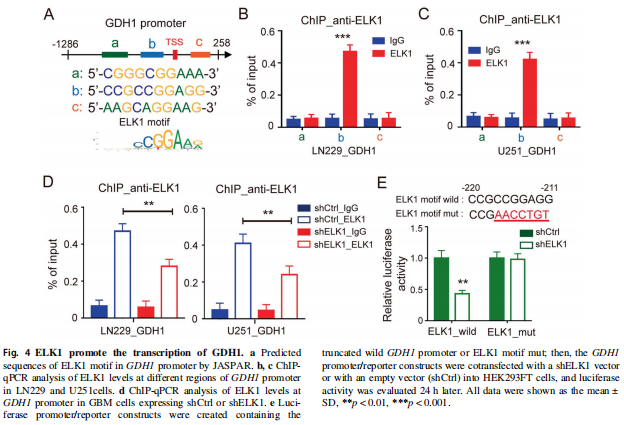
① 先确认ELK1对GDH1的调控机制
首先ELK1受到EGFR的调控是已有文献报道的。同时,对别人发表过的CHIP-seq数据分析,发现ELK1结合片段里存在GDH1的启动子区片段。最后再亲自下场,去JASPAR做GDH1启动子区的转录因子预测(Fig 4A),的确在GDH1启动子区预测到了ELK1的3个结合区域。
然后确定具体是哪个位点:先对GDH1启动子区序列进行截断构建,通过CHIP实验,可以确认ELK1与GDH1启动子的结合主要发生在(-220 to -211) 的位置(Fig 4B、C)。
最后证明:ELK1的表达沉默,可以抑制ELK1与GDH1启动子的结合(CHIP,Fig 6D),及GDH1启动子活性(荧光素酶实验,Fig 6E),进一步确认了ELK1与GDH1启动子(-220 to -211) 位点的结合作用,及通过结合对启动子活性的促进作用。
其实课题组还做了一份大工程:Q-PCR检测到ELK1沉默可以引起GDH1的表达下降,且利用临床数据库可以分析得出,在胶质瘤组织中,ELK1的表达与GDH1成正相关。(Fig 4的结果并不多,但这部分数据他们居然选择放在了补充材料里……)
② 然后确认EGFR对ELK1--GDH1的调控机制
这一步的主要是做文献检索,找到了既是EGFR下游,又是ELK1上游的明星通路“MEK/ERK”。
先简洁证明了EGF刺激(=EGFR激活)可以提高MEK/ERK通路蛋白的磷酸化程度(=通路活化程度)也增加了(WB, Fig 5A)。且ELK的磷酸化(同样,=活化)水平也相应增加了(Fig 5A),与GDH1启动子的结合能力(CHIP,Fig 5B)。
回复实验显示,对ELK1进行沉默处理。处于ELK1上游的MEK/ERK通路,活化程度并未发生改变而ELK1的表达及活化水平都有所下降(WB, Fig 5C),其与GDH1启动子的结合能力也出现了下降(WB, Fig 5D)。
而在此前提下,再次给予EGF/EGFR刺激,可以提高MEK/ERK通路的活化程度,但因为下游ELK1的总含量都受到了sh-ELK1的抑制,所以EGF/EGFR对ELK1活化及其与GDH1启动子结合能力的调控作用都不明显。
即证实了EGFR通过MEK/ERK通路,促进ELK1的活化,升高GDH1的转录表达。
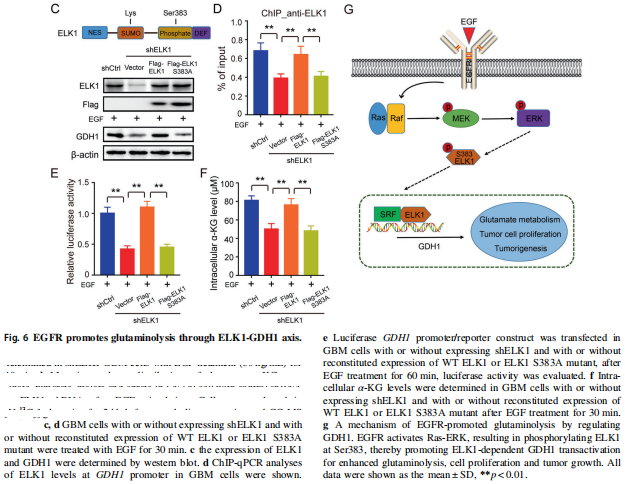
③ 回复实验,最终确认EGFR对ELK1--GDH1的调控机制
ELK1的沉默,可以逆转EGF/EGFR刺激对GDH1的表达,及下游代谢物α-KG的含量(Fig 6A)及α-KG下游各级代谢物的含量(同位素示踪+质谱分析,Fig 6B)的促进作用。但对GDH1上游的glutamate含量没有影响。
另外还验证了ELK1的沉默可以逆转EGF/EGFR刺激对胶质瘤细胞增殖活性的促进作用(结果放在了补充材料里)
①-③ 合起来看,就证实了EGFR通过MEK/ERK通路,促进ELK1的活化,升高GDH1的转录表达,从而促进了谷氨酰胺代谢途径,促进胶质瘤细胞的增殖。
表达高/低,或笼统的通路活化/抑制参与细胞功能调控的机制很常见。但具体到研究是哪一个活化位点参与的(机制足够深入了~),就相对少了很多。这应该也是这个课题的“高分”原因之一。
首先普及一下背景知识:ELK1是通过Ser383磷酸化位点发生磷酸化,从而发生核转位入核,发挥转录因子作用的(原理如Fig 6G)。所以这里课题组想要确定,EGFR-MEK/ERK是否是通过调控Ser383磷酸化位点,调控ELK1功能的。
课题组对胶质瘤细胞一方面进行了ELK1的沉默处理(sh-ELK1),然后对沉默后的胶质瘤细胞转入了野生型ELK1过表达质粒,和/或 Ser383位点突变型ELK1过表达质粒(Ser383A)。结果显示,两种过表达质粒都可以成功“回复”提高ELK1在细胞中的表达含量,但区别在于:野生型ELK1可以进一步“回复”GDH1在细胞中的表达含量(WB,Fig 6C),“回复”和提高ELK1与GDH1启动子区的结合能力(CHIP,Fig 6D),及GDH1启动子区的活性(荧光素酶实验,Fig 6E)。而Ser383突变型ELK1对这些功能丧失了调节作用。
相应的,野生型ELK1可以通过GDH1,最终“回复”和提高α-KG的含量(试剂盒检测,Fig 6F)。而Ser383突变型ELK1对α-KG的含量丧失了调节作用。
综上,确认了EGFR通过Ser383磷酸化位点调控ELK1的活性,并由此调节促进GDH1和谷氨酰胺代谢途径。
这份7分水平的SCI有没有觉得研究的也不是那么复杂。研究手段主要的就是MTT、WB、CHIP、荧光素酶启动子活性检测。其实就像最开始我们说的,在现在这个阶段,谷氨酰胺代谢本身就支撑起了一个课题最大的创新性,所以如果做这方面的研究,在实验手段方面要求没有太高。下次我们讲的一篇17分的文献,实验手法也同样“平平无奇”的很~
如果有需要咨询的地方
可以直接加微信或打电话问我噢!
联系方式:18570028002
