

ChIP实验全流程深度解析:从样本制备到结果验证的专业指导
 2025-07-10 17:53:04
2025-07-10 17:53:04
来源/作者:普拉特泽-生物医学整体课题外包平台
ChIP实验全流程深度由普拉特泽生物分子检测平台总结分享,分子检测平台为广大科研实验人员提供ChIP实验外包,先一起来学习从样本制备到结果验证的全流程
一、ChIP实验概述与原理
染色质免疫共沉淀(Chromatin Immunoprecipitation, ChIP)是研究蛋白质与DNA相互作用的关键技术,广泛应用于转录因子结合位点、组蛋白修饰等表观遗传学研究领域。
核心原理:通过特异性抗体富集与目标蛋白结合的DNA片段,结合高通量测序(ChIP-seq)或qPCR分析,精确定位蛋白-DNA相互作用位点。
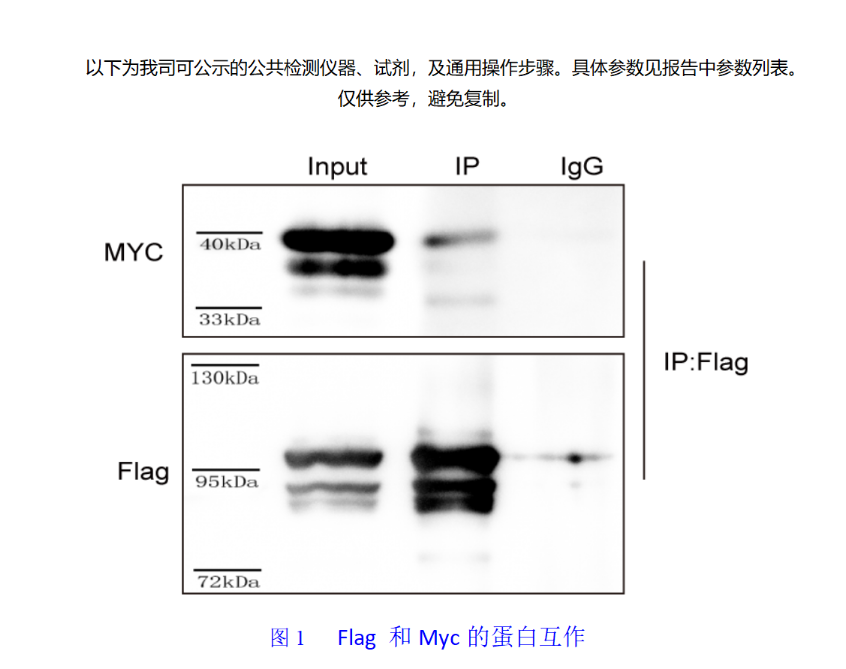
图1
二、样本制备关键步骤与优化策略
2.1 细胞培养与处理
细胞状态控制:确保细胞处于最佳生长状态(对数生长期)
交联条件优化:1%甲醛室温交联10-15分钟(根据细胞类型调整)
终止反应:使用终浓度0.125M甘氨酸终止交联
2.2 染色质片段化技术
超声破碎参数:
Bioruptor®推荐条件:30秒ON/30秒OFF,15-20个循环(4°C)
片段大小目标:200-500bp(需电泳验证)
酶解法(Micrococcal Nuclease)替代方案:适用于组蛋白修饰研究
2.3 质量控制要点
片段大小检测:1.5%琼脂糖凝胶电泳
浓度测定:Nanodrop或Qubit定量(建议≥50μg/反应)
三、免疫沉淀核心操作技巧
3.1 抗体选择标准
验证过的ChIP级抗体优先(查阅CST或Abcam数据库)
阴性对照:同型IgG对照
阳性对照:H3K4me3(活跃启动子标记)或H3K27me3(抑制性标记)
3.2 磁珠预处理
Protein A/G磁珠比例:根据抗体亚型优化(通常1:1混合)
封闭步骤:0.5% BSA+0.2mg/ml鲑鱼精DNA预处理1小时
3.3 结合条件优化
孵育时间:4°C过夜(12-16小时)
洗涤缓冲液配方:
低盐:20mM Tris-HCl(pH8.0), 150mM NaCl
高盐:20mM Tris-HCl(pH8.0), 500mM NaCl
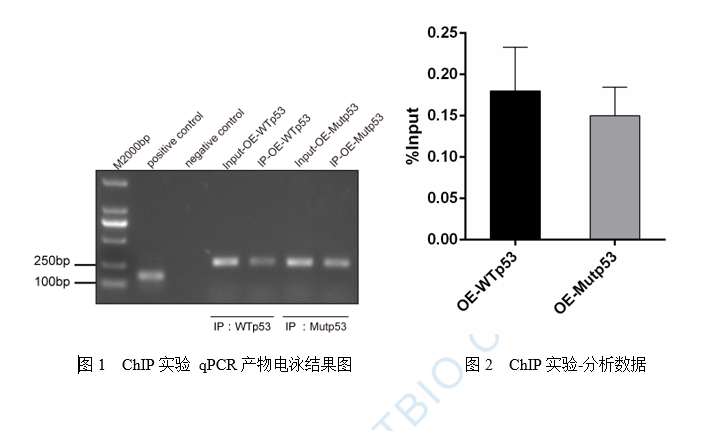
图2
四、DNA纯化与质量检测
4.1 解交联条件
65°C水浴6小时(含5M NaCl和10mg/ml蛋白酶K)
4.2 纯化方法选择
酚-氯仿抽提法:回收率高但操作复杂
硅胶柱纯化法:推荐使用QIAquick PCR Purification Kit
4.3 质量评估指标
浓度要求:≥1ng/μL(ChIP-seq)
完整性检测:Agilent 2100 Bioanalyzer(避免RNA污染)
五、下游分析技术选择
5.1 ChIP-qPCR验证
引物设计原则:
长度18-22bp,Tm值60±2°C
扩增片段80-150bp
数据分析方法:ΔΔCt法计算富集倍数
5.2 ChIP-seq文库构建
末端修复:T4 DNA聚合酶/Klenow片段混合系统
接头连接:推荐使用NEBNext Ultra II DNA Library Prep Kit
六、常见问题解决方案
6.1 低信号处理策略
抗体滴定实验:测试1-10μg抗体用量
增加起始材料:建议≥1×10^7细胞/反应
6.2 高背景解决方案
增加洗涤严格度:加入0.1% SDS或LiCl洗涤
DNase处理磁珠:去除非特异性DNA结合
还有更多疑问建议或需要ChIP实验外包的同学可点击“普拉特泽”了解咨询哦,提供原始数据,死磕真实实验!

