今天我们仍然来分享表观遗传相关的文献,那么是分享表观遗传的哪一方面呢?
应该大家看文献都会有碰到,那就是越来越火爆的泛素化过程。
当然,还是要通过权威数据来说明一下我们为什么要选择表观遗传的泛素化的文献进行分享。
在pubmed数据库中输入“ubiquitination”,可以得到的文章数量为85077篇,并在近20年来都是呈递增趋势。
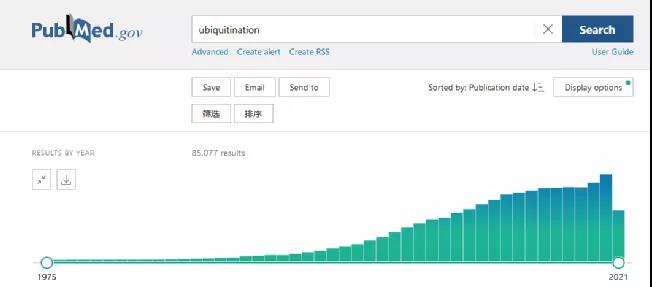
从国自然立项情况来看,特别是近两年的中标情况,与泛素化有关的课题中标率超过200个,基金总金额达9000多万元。结合已发表的文章数量以及国自然中标情况,表观遗传的泛素化方面的研究也是大有搞头的。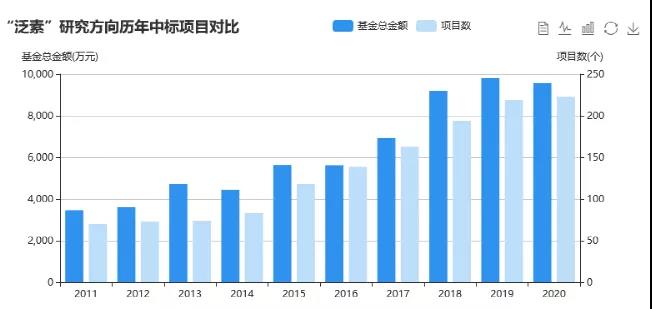
既然泛素化有这么多的科研工作者倾向于去研究,相信看文献的你也可能值得拥有。那么,首先让我们来一起了解一下什么是表观遗传的泛素化过程?表观遗传(Epigenetics)是指,在核酸序列不发生改变的情况下,遗传物质出现了可遗传的变化,从而导致可遗传的表型改变。目前,表观遗传学已从一个少有人关注的领域变成如今的研究热点。泛素化是指泛素(一类低分子量的蛋白质)分子在一系列特殊的酶作用下(涉及泛素激活酶E1、泛素结合酶E2和泛素连接酶E3),将细胞内的蛋白质分类,从中选出靶蛋白分子,并对靶蛋白进行特异性修饰的过程。泛素化在蛋白质的定位、代谢、功能、调节和降解中都起着十分重要的作用。而且,它还参与细胞周期、增殖、凋亡、分化、转移、基因表达、转录调节、信号传递、损伤修复、炎症免疫等几乎一切生命活动的调控。泛素化与多种疾病类型如肿瘤、心血管等发病密切相关。因此,泛素化的研究越来越多。
接下来,通过文献分享的形式来讲述泛素化如何在生命过程中参与调节。
这次分享的文献题目是:Ubiquitin-specific protease 2a promotes hepatocellular carcinoma progression via deubiquitination and stabilization of RAB1A,影响因子为6.370分,发表在Cellular Oncology杂志上,发表时间为2020年10月,该文章主要探究了泛素特异性蛋白酶2a通过去泛素化和RAB1A的稳定促进肝癌进展。
一、USP2a在HCC中的表达显著增加,
并与较差的病理分级、淋巴转移和不良预后呈正相关
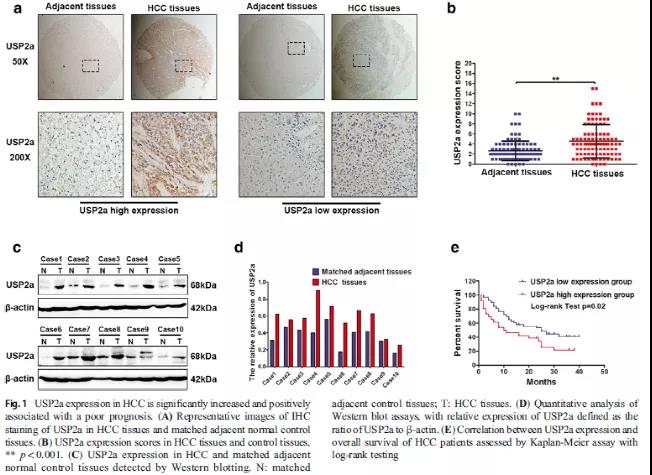
首先通过组织芯片(包含100对HCC和匹配的邻近组织的组织)、免疫组化染色和WB实验检测USP2a的蛋白表达情况,结果显示,不管是免疫组化还是WB实验的结果都表明USP2a在肝癌组织中表达显著增高(Fig 1A-D);接下来,评估了USP2a表达与几种临床病理特征之间的相关性,发现USP2a表达与分化不良的病理分级和肝门静脉淋巴结转移呈正相关,而USP2a表达与患者性别、年龄、肿瘤大小或HBV感染等其他临床病理特征无显著相关性(Table 1);而且,Kaplan-Meier生存分析显示USP2a的高表达与患者预后较差(Fig 1E)。以上结果说明,USP2a在肝癌中是一个致癌因子。
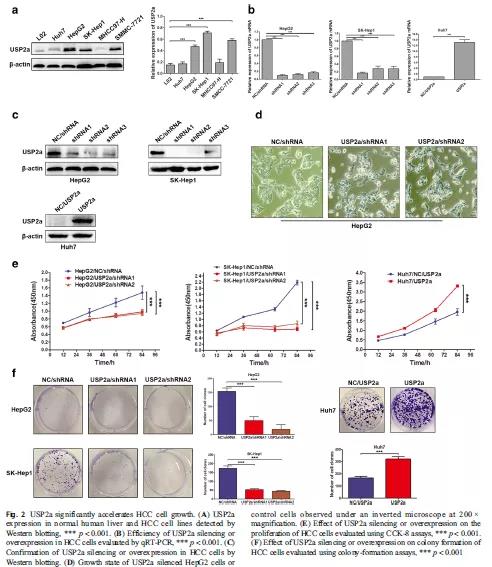
接着,作者在5株肝癌细胞中检测了USP2a的表达情况。结果显示,USP2a在其中3株细胞中表达显著增高,另外两株无显著性影响(Fig 2A)。为了进一步验证USP2a在肝癌细胞的生物学作用,作者对USP2a进行了敲降或过表达,并在mRNA水平和蛋白水平层面进行了效果验证(Fig 2B-C)。通过功能学实验检测得到,敲降USP2a肝癌细胞组的生长率、增殖、克隆形成率相比对照组显著下降,而过表达USP2a肝癌细胞组得到的结果相反(Fig 2D-F)。以上结果说明,USP2a可以促进肝癌细胞的生长,进一步验证了USP2a在肝癌中是一个致癌因子。
有文献报道,SK-Hep1细胞被认为具有间质特征,可导致更多的转移潜能。通过显微镜观察到SK-Hep1细胞的分布是分散的,但USP2a沉默的SK-Hep1肝癌细胞开始聚集(Fig 3A)。这一观察结果提示USP2a可能参与了HCC细胞转移。接着,采用划痕实验、Transwell迁移和侵袭实验表明,USP2a沉默的SK-Hep1肝癌细胞的迁移和侵袭能力都弱于对照组,而过表达USP2a肝癌细胞的迁移能力则显著强于对照组(Fig 3B-G)。以上结果说明,USP2a能促进肝癌细胞的迁移和侵袭等生物学过程,促进肝癌的发展。
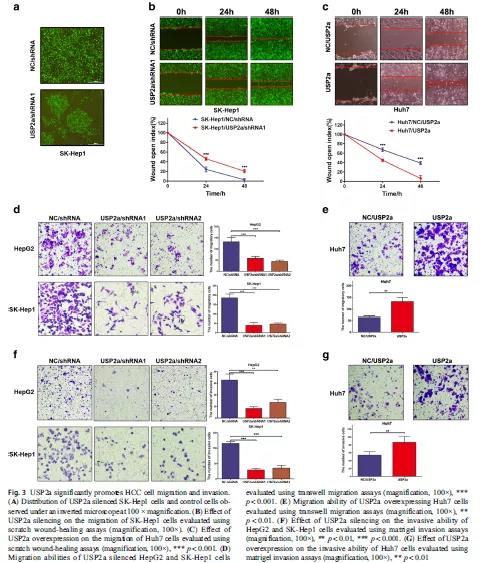
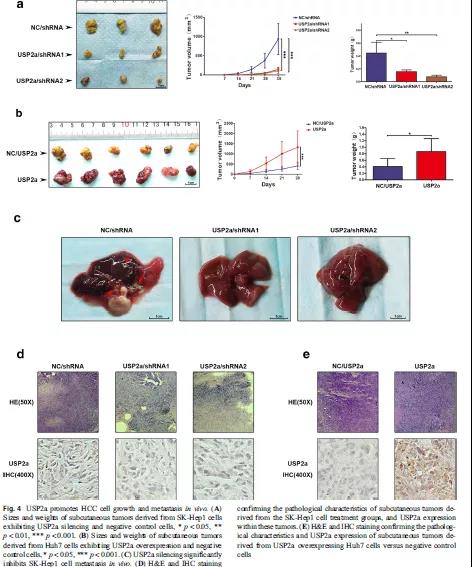
通过体外实验已证实,USP2a可促进肝癌细胞的增殖、迁移和侵袭,那在小鼠体内会如何影响肿瘤的发生发展呢?采用SK-Hep1细胞、USP2a敲降的SK-Hep1细胞、USP2a过表达的SK-Hep1细胞对裸鼠进行皮下成瘤,5周后处死小鼠,比较肿瘤的大小。结果显示,USP2a敲降组的肿瘤重量远轻于对照组,而USP2a过表达组的肿瘤重量显著性重于对照组(Fig 4A-B)。同时,在接种USP2a沉默的SK-Hep1细胞的小鼠腹腔内未发现转移结节,而对照组出现多处转移结节(Fig 4C)。通过H&E染色说明所有肿瘤的病理特征均符合恶性病变,USP2a表达通过免疫组化染色进行检测,USP2a过表达组的USP2a表达比对照组更高,而USP2a敲降组比对照组更低(Fig 4D-E)。以上结果说明,USP2a在小鼠体内实验中促进了肿瘤的生长和转移。
五、在肝癌细胞中,USP2a可与RAB1A相互作用
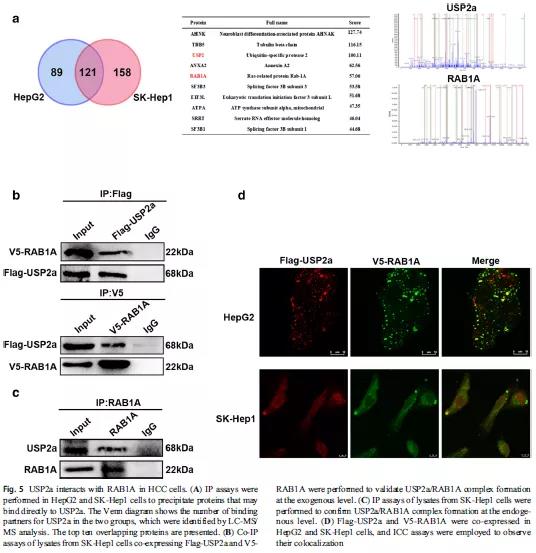
前面的结果已说明USP2a在肝癌中的作用,但是其具体作用机制并不清楚。以前有文献说明USP2a可能通过靶向癌细胞相关蛋白参与癌症进展。于是,作者采用免疫沉淀实验来探索与USP2a可能结合的蛋白,再通过LC-MS/MS分析得到,从HepG2细胞中鉴定出210个蛋白,从SKHep1细胞中鉴定出279个蛋白,其中121个蛋白一致。其中,已有研究报道RAB1A可能促进癌细胞的增殖、迁移和侵袭,因此,作者推测,在这些重叠的蛋白质中, RAB1A可能作为USP2a的下游靶标(Fig 5A)。免疫共沉淀实验(Co-IP)说明USP2a能与RAB1A结合,同时,在SK-Hep1细胞内源性IP实验发现内源性RAB1A可以与内源性USP2a形成复合物(Fig 5B-C),免疫荧光染色显示USP2a和RAB1A共定位于HepG2和SK-Hep1细胞的细胞质中(Fig 5D)。以上实验结果表明,USP2a可与RAB1A在肝癌细胞中相互结合,RAB1A是USP2a的靶基因。
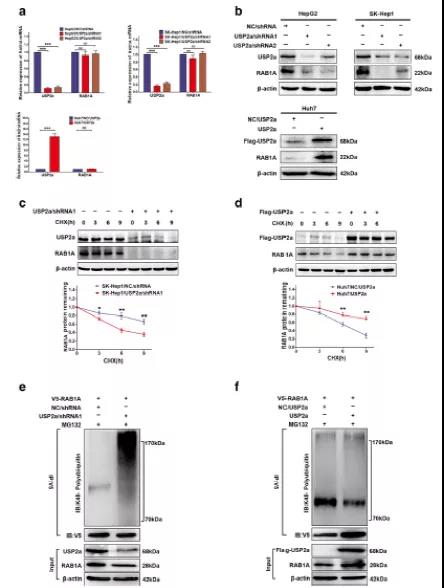
虽然USP2a能与RAB1A结合,但其对生物学功能的影响还未知。首先,作者通过qPCR实验检测了USP2a敲降/过表达对RAB1A表达的影响,结果表明,RAB1A的表达不受USP2a敲降/过表达的影响,表达基本不变(Fig 6A)。然而, USP2a敲降/过表达显著影响了RAB1A的蛋白水平,敲降USP2a,RAB1A表达降低,过表达USP2a,RAB1A表达显著升高(Fig 6B)。以上结果推测,USP2a可以通过泛素-蛋白酶体途径抑制靶蛋白的降解。通过CHX追踪分析,发现USP2a沉默后,RAB1A在SK-Hep1细胞中的半衰期降低,而过表达USP2a,则RAB1A的半衰期延长(Fig 6C-D)。此结果说明USP2a可以稳定RAB1A的表达。同时,通过MG132(蛋白酶体抑制剂)来说明USP2a对RAB1A泛素化的影响。SKHep1细胞被携带的慢病毒共同感染USP2a/shRNA1或RAB1A,随后处理MG132持续6小时。然后提取细胞中蛋白质进行IP实验,结果发现与对照细胞相比,USP2a敲降细胞中RAB1A的K48-特异性多聚泛素化显著增加,而过表达USP2a细胞中则出现相反的结果(Fig 6E-F)。以上结果说明,USP2a可以稳定RAB1A,并通过去泛素化保护RAB1A不被降解。



 2021-11-18 08:44:58
2021-11-18 08:44:58









