

2025年KO 细胞培养全攻略:新手也能学会的操作技巧与常见问题解答
 2025-10-13 17:42:20
2025-10-13 17:42:20
来源/作者:普拉特泽-生物医学整体课题外包平台
转染适配性:常规细胞可选脂质体转染,难转染的原代细胞、免疫细胞建议采用电转或慢病毒递送系统;
基因表达验证:通过 qPCR 提前确认目标基因在所选细胞系中表达,否则无法通过后续功能实验验证敲除效果。
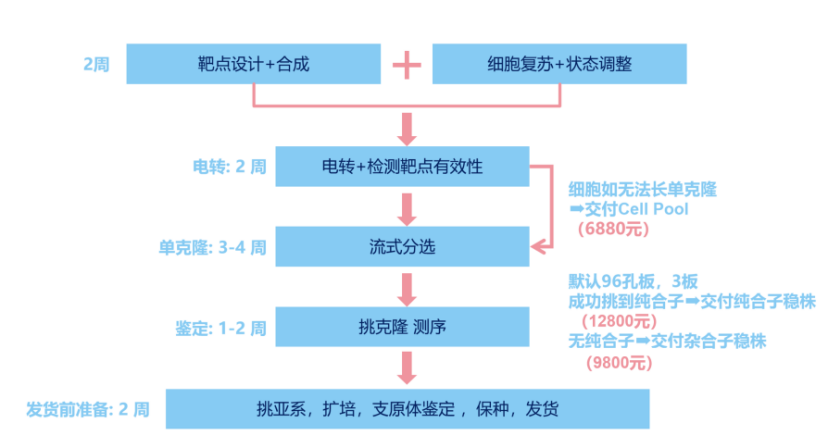
新手贴士:若时间紧张,可直接选用 8000 + 现货 KO 细胞库资源,涵盖常见研究基因,即拿即用无需自行构建。
解冻操作:37℃水浴锅中快速晃动冻存管,待冰晶剩余 1/3 时立即取出,避免温度过高导致细胞损伤;
离心保护:1000rpm 离心 5 分钟后,用含 10% FBS 的完全培养基重悬,切忌直接吹打细胞团;
密度把控:复苏初期细胞密度维持在 5×10⁵ cells/mL,贴壁细胞需静置 6-8 小时再更换培养基。
培养基定制:CHO-K1 等工程细胞系可在基础培养基中添加 2mg/L 重组胰岛素,细胞增殖效率提升 17%,蛋白产量提高 51%;
气体平衡:CO₂浓度严格控制在 5%,湿度保持 95% 以上,避免培养基 pH 波动超过 0.2;
传代时机:贴壁细胞融合度达 70%-80% 时传代,悬浮细胞密度至 2×10⁶ cells/mL 时稀释,过度密集易导致细胞凋亡。
极限稀释法:将细胞稀释至 0.5 个 / 孔,添加 20% 条件培养基(同系细胞上清),克隆形成率提升 30%;
FACS 分选法:对带荧光标记的细胞进行单细胞分选,适用于难筛选的悬浮细胞,分选后需静置 24 小时再观察;
克隆鉴定:至少扩增 50-100 个单克隆,通过 PCR + 测序确认双等位基因敲除,避免杂合克隆干扰实验。
问题根源:sgRNA 设计不合理或转染方式错配;
解决策略:
用 CRISPick、CHOPCHOP 工具设计 GC 含量 40%-60% 的 sgRNA,优先选择早期外显子靶点;
难转染细胞采用 Cas9 RNP(蛋白 + sgRNA 复合物)瞬时递送,降低脱靶同时提升效率。
问题根源:双等位基因编辑概率低(通常 < 10%),或目标基因为必需基因;
解决策略:
同时设计 3 个不同 sgRNA 靶点,编辑效率可提升至 40% 以上;
必需基因改用条件性 KO 或 CRISPRi(基因沉默)方案,避免细胞死亡。
问题根源:培养基营养不足或存在支原体污染;
解决策略:
fed-batch 培养模式中,每 48 小时添加含 8mg/L 重组胰岛素的补料培养基,蛋白产量提高 49%;
每周用 PCR 检测支原体,污染细胞用 0.1% 庆大霉素处理 24 小时。
问题根源:Cas9 持续表达或 sgRNA 同源性过高;
解决策略:
选用高保真 Cas9 蛋白,减少非特异性切割;
验证阶段结合 Sanger 测序(基因组层面)+Western Blot(蛋白层面)双重确认。
问题根源:冻存液配方不当或降温速度失控;
解决策略:
采用 10% DMSO+90% FBS 冻存液,贴壁细胞可额外添加 5% 海藻糖;
程序降温盒中 - 80℃静置 12 小时后转移至液氮,避免直接冷冻。
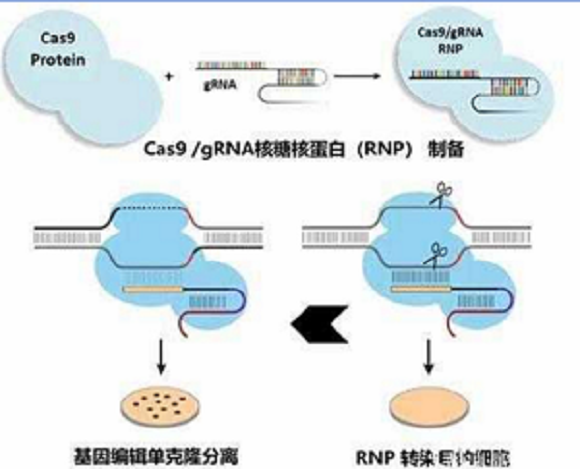
基因组层面:PCR 扩增目标基因片段,Sanger 测序确认移码突变或片段缺失;
蛋白层面:Western Blot 检测目标蛋白表达,无条带或条带显著减弱即为有效敲除;
功能层面:通过流式细胞术、免疫荧光或细胞增殖实验验证表型变化,例如肿瘤相关基因 KO 后需检测细胞凋亡率。
设计工具:源井生物 EZ-editor™系统(1 分钟生成 3 套敲除方案)、CRISPOR(脱靶预测);
培养试剂:无血清化学成分限定培养基(适合 CHO-K1 细胞)、重组胰岛素补料(提升产能);
验证试剂盒:T7E1 核酸酶检测试剂盒(快速评估编辑效率)、WB 内参抗体(确保实验可靠性)。
如果想知道更多的关于KO 细胞培养的相关案例和知识点,以及专属研究方法,也可以联系我们:18570028002 或 微信 pulateze666会把这些资料发送给大家哦。

