

原代细胞 vs 细胞系:培养差异与精准鉴定策略
 2025-06-11 16:51:47
2025-06-11 16:51:47
来源/作者:普拉特泽-生物医学整体课题外包平台
细胞培养瓶中的抉择,决定了研究结果的生物学意义。
生物医学研究中,细胞模型的选择直接影响实验结果的可靠性和相关性。原代细胞直接来源于活体组织,保留了生物体的生理特性和异质性,但培养难度高且寿命有限。普拉特泽生物承接原代细胞等细胞实验相关服务上万例,积累了操作大量经验
为大家详细分享原代细胞 vs 细胞系,同时为广大科研工作者开展线上的理论培训与线下实操,可承接染色实验外包服务
细胞系则能在实验室环境中长期稳定传代,操作便捷但可能逐渐丧失原始组织的生物学特性。这两类细胞工具在药物研发、疾病建模和基础研究中扮演着不可替代的角色。
01 基本概念与核心差异
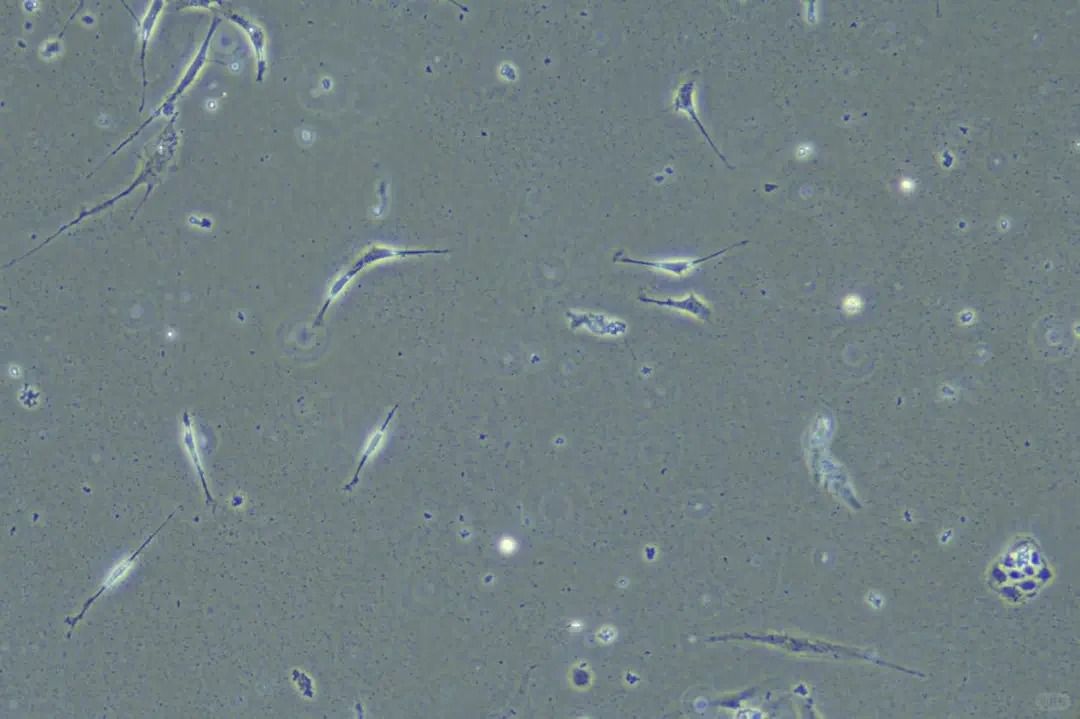
从机体组织中分离的细胞在体外培养的命运走向两个方向:原代细胞与细胞系。
原代细胞(primary cell)是指从机体组织中经蛋白酶或其他方法直接分离获得,并在体外进行模拟机体环境培养的细胞。一般认为,从第1代到第10代以内的细胞培养都属于原代细胞范畴。
当原代细胞经历首次成功传代后,它们就转变为细胞系(cell line)。细胞系又可分为两个亚型:有限细胞系(传代次数有限)和连续细胞系(可无限传代)。著名的HeLa细胞就是最具代表性的无限细胞系,自1951年分离以来仍在全球实验室中增殖。
细胞株(cell line)则是通过选择或克隆形成法从原代培养物或细胞系中获得的具有特殊性质或标志物的细胞群。其特殊性质必须在整个培养期间持续存在,同样分为有限细胞株和连续细胞株。
表:原代细胞与细胞系的核心差异对比
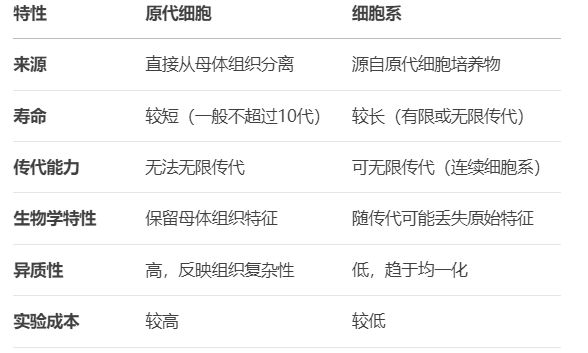
原代细胞最显著的优势在于它们更接近和更能反映体内生长特性,是药物敏感性试验、细胞分化等研究的理想工具。而细胞系的主要优势在于其无限增殖能力,便于实验重复,更适合长期研究项目。
02 培养技术差异
原代细胞培养是门精细艺术,而细胞系培养则更像标准化生产。
①原代细胞培养方法
原代细胞培养主要有四种技术路径:
㈠组织块培养法是将剪成的小组织团块接种于培养瓶中,瓶壁通常预先涂以胶原薄层,以利于组织块粘着瓶壁,使周边细胞能沿瓶壁向外生长。
㈡消化培养法则是将妨碍细胞生长的细胞间质(包括基质、纤维等)通过酶处理去除,使细胞分散形成细胞悬液,然后分瓶培养。这种方法能获得更纯净的细胞群体。
悬浮细胞培养法针对天然悬浮生长的细胞,如淋巴细胞、骨髓细胞和免疫细胞。这些细胞无需消化,可采用低速离心分离,直接培养,或经淋巴细胞分层液分离后接种培养。
器官培养是一种特殊形式,从供体取得器官或组织块后,不进行组织分离而直接在体外的特定环境条件下培养,其特性仍保持原有器官细胞的组织结构和联系。
▲关键培养要素
原代细胞培养需要特别注意三个关键参数:培养液和培养物的比例必须适当,一定浓度的培养物仅能支持一定数量的细胞生长;pH值应维持在7.4左右,培养过程中不低于7.0;培养瓶内的空间比例也有讲究,一般培养液与液面上空间体积之比为1:10。
换液操作时,培养基预热是必要的,可减少环境改变对细胞状态的影响。部分贴壁不牢固的细胞在受冷时容易收缩导致漂浮,延长适应环境时间。
▲细胞系传代技术
细胞系根据生长方式分为贴壁细胞和悬浮细胞两类:
→悬浮细胞传代相对简单:待细胞长满至80%~90%(细胞悬液变黄),用吸管吸弃细胞悬液1/2~1/3,加入适量新鲜培养基即可继续培养。当发现细胞碎片时,可采用离心传代法:将细胞悬液离心(150g,5分钟),弃上清,用新鲜培养基重悬后分装至新培养瓶。
→贴壁细胞传代遵循标准流程:清洗—消化—终止—标记。消化环节尤为关键,胰酶需要在4℃环境中保存,使用前恢复常温,消化时置于37℃环境中。但不建议整瓶预热,反复多次预热会导致剩余胰酶失活。
03 精准鉴定策略
▲随着传代次数增加,细胞身份确认成为保证研究可重复性的关键。
原代细胞的稳定性挑战
▲原代细胞在传代过程中面临遗传漂变和表型改变的双重挑战。以常见的小鼠星形胶质细胞为例,在纯度和状态都较好的情况下,通常只能传3-5代。
□细胞鉴定关键技术
STR分析已成为细胞身份鉴定的金标准。该技术通过检测短串联重复序列的重复次数差异来确认细胞唯一性。武汉赛尔朗灵公司将其培养的新型癌种细胞经过STR鉴定,并将数据提交至ATCC数据库进行比对,证实是“一例全球未记录过的细胞”。
核型分析可检测染色体数目和结构异常,是识别细胞是否发生转化的有效手段。免疫组化鉴定则通过特定蛋白标志物的表达确认细胞类型和分化状态。这些技术组合应用,构成细胞身份认证的多重保障系统。
□细胞污染与碎片识别
细胞培养中常见的“黑点”问题常让研究者困惑:是污染还是碎片?当黑点不增殖、大小不均匀,高倍镜下在原地震动,通常是细胞碎片。若黑点增殖、分布均匀,培养基变浑浊,则很可能是污染。
细胞碎片产生有四大原因:细胞悬浮液处理不当(过度振荡);细胞密度过高导致摩擦增加;细胞自然死亡;运输环境压力导致的应激反应。针对碎片问题,可采用PBS轻柔洗涤、控制胰酶消化时间、避免过度搅拌等技术手段减少其产生。
04 应用场景分析
不同的研究目标决定了细胞类型的选择策略。
▲原代细胞的独特价值
原代细胞在需要高度模拟体内环境的研究中具有不可替代的优势。瑞士生物科技公司ArcoScreen开发的GPCR原代细胞筛选平台就是一个典型案例。该平台基于微流控技术,能够直接在患者原代细胞中识别分子作用模式。
该技术能在昂贵的临床试验前快速、早期地预测药物疗效,将Ⅱ期临床试验的失败率降低50%。作为唯一能直接对患者原代细胞进行非放射性GPCR筛选检测的平台,它能保留GPCR的原生环境,测试任意哺乳动物的原代细胞,帮助制药公司更有效地测试药物候选分子在患者体内的真实作用模式。
▲细胞系的规模化优势
在需要大规模、高通量筛选的场景中,细胞系展现出明显优势。ArcoScreen拥有HEK-TRex或CHO-TRex细胞中85种人类GPCR可诱导细胞系库,可提供完整的稳定细胞系开发服务。这种标准化细胞资源为药物筛选提供了稳定、可重复的实验基础。
癌细胞系研究也依赖细胞系模型。虽然癌细胞系没有接触抑制特性,会叠着生长,但实际操作中,大部分癌细胞在营养消耗过快和环境恶化影响下,常未叠起就死亡,这也模拟了肿瘤内部的竞争环境。
▲特殊细胞类型的培养策略
不同细胞类型需要量身定制的培养方案:
内皮细胞培养中,血清含量需要精确控制。通常5%的血清浓度,既能保证内皮细胞的正常增殖,又能抑制其他细胞的生长。
上皮细胞培养挑战较大。当上皮细胞生长困难时,可尝试提高接种密度,换用较小培养皿,使用上皮专用培养基,并用0.1mg/ml胶原蛋白包被培养瓶。
干细胞培养要防止过早分化。关键是保证适宜的培养条件,选用高质量血清或无血清专用培养基,及时传代,并保持每次传代比例一致。

05 常见问题解答
问:原代细胞传代后冻存,复苏后算哪一代?
传代20次后冻存的细胞,复苏后应计为第21代。冻存操作只是让细胞在超低温环境下处于暂停状态,不会影响细胞代数计算。
问:如何提高原代细胞增殖速度?
原代细胞对起始接种密度有要求,且需要适应新环境3-5天。建议保证合适接种密度,48小时内静置培养,避免移动破坏细胞微环境。选择适宜的培养基和培养表面包被(如胶原蛋白)也能促进增殖。
问:能否仅用EDTA消化细胞?
可以仅用EDTA消化,但因其消化效果较弱,只适用于贴壁不牢、极易消化的细胞类型。对于贴壁牢固的细胞,EDTA单独使用效果有限。
问:间充质干细胞需要特殊培养条件吗?
常见间充质干细胞可用含正常血清含量的培养基培养,也可根据实验需求选择无血清培养基。消化时,虽然传统使用胰酶,但会对细胞造成累积损伤,建议使用消化效果更温和的干细胞专用消化液。
如果想知道更多的关于原代细胞培养的相关文献和知识点,以及专属研究方法,也可以联系我们:18570028002 或 微信 pulateze666会把这些资料发送给大家哦。
↓↓↓↓下面是我们实验交流群哦!和众多科研小伙伴一起交流学习

