

细胞增殖实验全流程详解:从样本处理到数据解读(附避坑指南)
 2025-05-14 17:25:03
2025-05-14 17:25:03
来源/作者:普拉特泽-生物医学整体课题外包平台
本文就给小白们从样本处理到数据解读细细讲讲,梳理夯实一下基础。
细胞增殖实验是评估细胞活性、药物毒性及肿瘤生长机制的核心技术。然而,由于操作细节繁多,实验失败率高达40%。普拉特泽生物结合《Nature Protocols》最新标准与实验室实战经验,系统解析实验全流程,并提供10大避坑技巧,助大家轻松获得可靠数据!
一、实验方法选择:四大主流技术对比
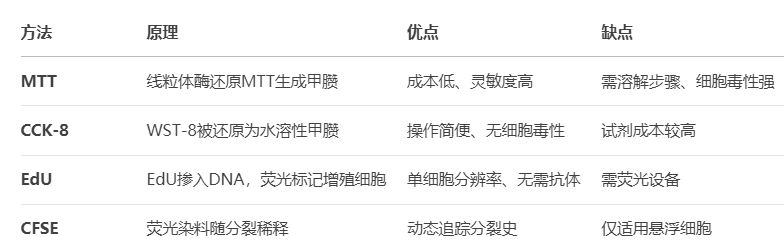
选择建议:
初筛实验 → MTT(低成本)
精准定量 → CCK-8(操作简单)
单细胞分析 → EdU(高分辨率)
二、实验全流程分步解析
1. 样本处理:细胞培养与准备
关键步骤:
1.细胞复苏与传代:
2.使用对数生长期细胞(传代次数≤10)。
3.胰酶消化时间控制(贴壁细胞:37℃ 2-5分钟)。
细胞计数与铺板:
1.自动细胞计数器确保精度(推荐Countess II)。
2.铺板密度参考(贴壁细胞:5×10³~1×10⁴/孔)。
避坑指南:
1.避免使用过密或过稀的细胞(OD值偏差>20%)。
2.预实验确定最佳密度(梯度测试3个浓度)。
2. 试剂准备与处理
MTT/CCK-8法:
试剂配制:
MTT:0.5 mg/mL(PBS溶解,避光保存)。
CCK-8:直接使用,无需稀释。
注意事项:
①试剂使用前平衡至室温(减少温度波动影响)。
②避光保存,避免反复冻融。
避坑指南:
▲勿将CCK-8直接接触金属(氧化失效)。
▲新批次试剂需与旧批次平行测试(误差<10%)。
3. 实验操作:孵育与检测
MTT法流程:
●加入MTT(10 μL/孔),37℃孵育4小时。
●吸弃培养基,加入DMSO(100 μL/孔)溶解甲臜。
酶标仪检测570 nm吸光度。
CCK-8法流程:
●加入CCK-8(10 μL/孔),孵育1-4小时。
●直接检测450 nm吸光度(无需溶解)。
避坑指南:
避免孵育时间过长(CCK-8超过4小时易饱和)。
使用多通道移液器减少孔间误差。
4. 数据采集与分析
数据处理公式:
细胞增殖率:
math\text{增殖率} = \frac{\text{实验组OD} - \text{空白孔OD}}{\text{对照组OD} - \text{空白孔OD}} \times 100\%
数据标准化:Z-score法剔除异常值(阈值±2.5 SD)
避坑指南:
▲忽略空白对照(背景干扰导致数据虚高)。
▲ 每板设置阳性/阴性对照(验证试剂有效性)。
三、10大避坑技巧总结
▲细胞状态优先:使用活力>95%的细胞,死细胞比例每增5%,OD偏差升20%。
▲边缘效应控制:96孔板外围孔加PBS缓冲液,湿度维持>90%。
▲试剂批次验证:新批次MTT需与旧批次平行测试。
▲孵育时间精准:MTT严格4小时,CCK-8不超过4小时。
▲溶解步骤规范:DMSO分次吹打混匀,避免气泡。
▲设备校准:酶标仪每月用标准滤光片校准。
▲数据归一化:使用参考对照(如10% FBS组)校正批次差异。
▲避免血清干扰:检测前更换为无血清培养基。
▲操作同步:多通道移液器统一加样,缩短时间差。
▲异常值处理:Z-score法剔除±2.5 SD外的数据。
四、常见问题与解决方案
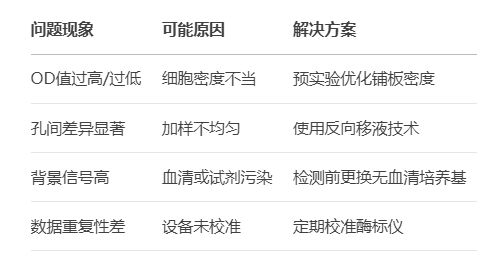
五、进阶优化:提升实验效率
自动化方案:机械臂自动铺板(CV<5%)。
3D培养适配:使用CellTiter-Glo 3D试剂检测类器官。
AI辅助分析:深度学习自动识别EdU阳性细胞。
普拉特泽,坚持提供真实、完整、唯一原始数据、原始图片。
普拉特泽生物,自有专业动物房、造模实验室,配套设备齐全,技术团队成熟,熟练掌握各类动物模型构建,更有细胞、分子、病理平台,一站式解决后续相关实验检测。请点击细胞实验平台了解详情。

