原核重组蛋白表达纯化多少钱?几千起高效交付
 2025-10-20 17:46:51
2025-10-20 17:46:51
来源/作者:普拉特泽-生物医学整体课题外包平台
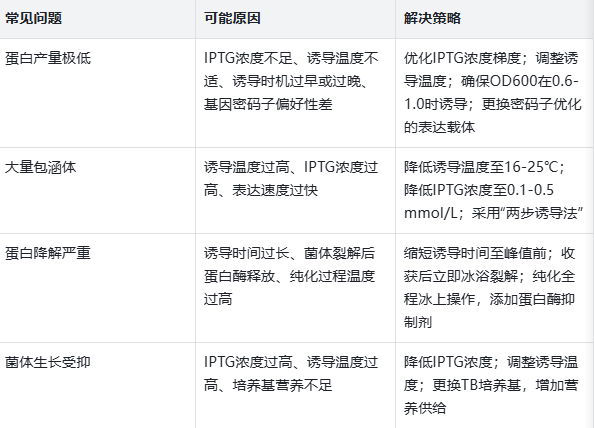
基础浓度范围:常规外源蛋白的诱导,IPTG终浓度建议从0.1 mmol/L到1.0 mmol/L进行梯度测试,这是经过大量实验验证的“安全有效区间”。
低浓度优先测试:对于分子量较大、结构复杂(如含多个跨膜区)的蛋白,建议先从0.1-0.5 mmol/L的低浓度开始测试,降低包涵体形成概率;对于小分子、易折叠的蛋白,可适当提高浓度至0.5-1.0 mmol/L。
特殊情况调整:若使用T7强启动子系统,由于启动效率极高,低浓度IPTG(0.1-0.3 mmol/L)即可满足需求,过高浓度反而易导致菌体裂解;若诱导后菌体生长缓慢,可直接降低浓度至0.2 mmol/L以下。
梯度温度测试:建议设置37℃、30℃、25℃、16℃四个梯度,这是覆盖“高效合成”与“高效折叠”的核心区间。例如:酶类蛋白多适合16-25℃诱导,而结构简单的标签蛋白可在37℃高效表达。
结合菌体密度调整:37℃诱导时,菌体生长快,可在OD600达到0.6-0.8时加入IPTG,诱导时间3-5小时即可;16℃低温诱导时,菌体生长慢,建议OD600达到0.8-1.0时诱导,诱导时间延长至12-20小时(过夜诱导)。
包涵体的“挽救”策略:若37℃诱导出现大量包涵体,可尝试“两步诱导法”——先在37℃诱导1小时启动表达,再降温至16℃继续诱导16小时,利用前期快速合成积累的蛋白,在低温下完成折叠。
基础时间梯度:根据温度设置梯度,37℃时每1小时取样一次(3-5小时内),16℃时每4小时取样一次(12-20小时内),通过SDS-PAGE电泳检测蛋白表达量,找到峰值时间。
启动子适配原则:强启动子(如T7)表达速度快,峰值出现早,37℃下3-4小时即可达到峰值;弱启动子(如lac)表达速度慢,峰值出现晚,可能需要延长至5-6小时。
避免过度诱导:诱导时间超过峰值后,即使继续培养,蛋白量也不会增加,反而可能因菌体裂解导致蛋白释放到培养基中,增加纯化难度,因此需严格把控收获时间。
诱导时机:菌体对数生长期是“黄金窗口”:诱导必须在菌体处于对数生长期(OD600=0.6-1.0)时进行,此时菌体代谢旺盛,蛋白合成能力最强。若在OD600<0.6的延迟期诱导,菌体活力不足,表达量低;若在OD600>1.0的稳定期诱导,菌体代谢减缓,且可能积累代谢废物,影响蛋白质量。
培养基成分:适配菌体生长与蛋白表达:LB培养基是常规选择,但对于高需求蛋白,可使用TB培养基(含胰蛋白胨、酵母提取物、甘油),甘油能提供更持久的碳源,延长菌体对数生长期,提高表达量;若蛋白需要特定金属离子辅助折叠(如金属酶),可在培养基中添加适量Mg²+、Mn²+等。
pH值与渗透压:维持菌体稳定:诱导过程中,菌体代谢会产生酸性物质,导致培养基pH下降,影响菌体活力。可在培养基中加入10-20 mmol/L的Tris-HCl(pH7.5)缓冲液稳定pH;对于盐敏感菌株,需控制培养基渗透压,避免菌体裂解。