

什么?腰椎疼痛被确诊为乳腺癌!【文献导读】
 2020-12-17 15:29:54
2020-12-17 15:29:54
来源/作者:普拉特泽生物-医学整体课题外包
早期乳腺癌的症状多不明显,晚期乳腺癌可发生癌细胞远处转移,出现全身多器官病变,直接威胁患者的生命。目前,患乳腺癌后的骨转移是乳腺癌高死亡率的主要原因(70%占比),那是否有方法通过调节免疫特性,去减少转移性生长呢?这篇发表于Cancer Research上的文章就为大家做了详细的讲解~

结论:
作者揭示了ERRα通过增加骨微环境的免疫活性来抑制乳腺癌细胞的骨转移。乳腺癌骨转移中ERRα的过表达诱导趋化因子CCL17和CCL20的表达,并抑制转化生长因子β3(TGF-β3)的产生。随后,募集到骨转移的CD8 + T淋巴细胞逃脱了TGF-β信号的控制,并具有加剧的细胞毒性特征,从而大大减少了转移。作者在小鼠中发现的临床相关性在240多名乳腺癌患者中得到了证实。因此,这项研究表明,ERRα调节骨骼微环境中的免疫特性,有助于减少转移性生长。
正文解读
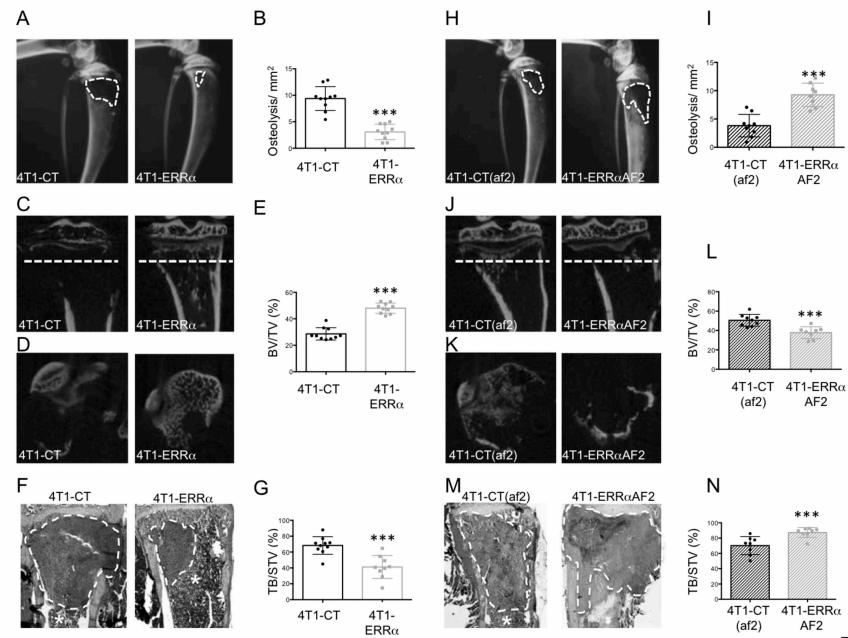
Fig1:在晚期乳腺癌中过表达ERRα模型抑制骨转移发育
作者首先将4T1-CT;4T1-ERRα;4T1-CT(af2);4T1-ERRαAF2细胞接种到BALB / c小鼠中。接种后13-15天,分析溶骨性病变。图A~G为4T1-CT与4T1-ERRα对照组。图H~N为4T1-CT(af2)与4T1-ERRαAF2对照组。
图1 A:CT拍照,溶骨区用虚线划分。
图1 B:骨溶解显示溶骨性病变的平均大小。
图1 C、D:胫骨的矢状切面(C)和横切面(D)的三维微ct重建表示,跟随骨沿平面的切割,在C中以虚线表示。
图1 E:骨体积/组织显示体积百分比。
图1 F:三色染色后骨骼切片的组织学图像。肿瘤用虚线和*表示骨髓。
图1 G:肿瘤负荷/软组织体积百分比。
结果显示,在晚期乳腺癌中,ERRα过表达组的骨溶解减少,ERRαAF2(ERRα功能域突变)实验组的骨溶解增加。
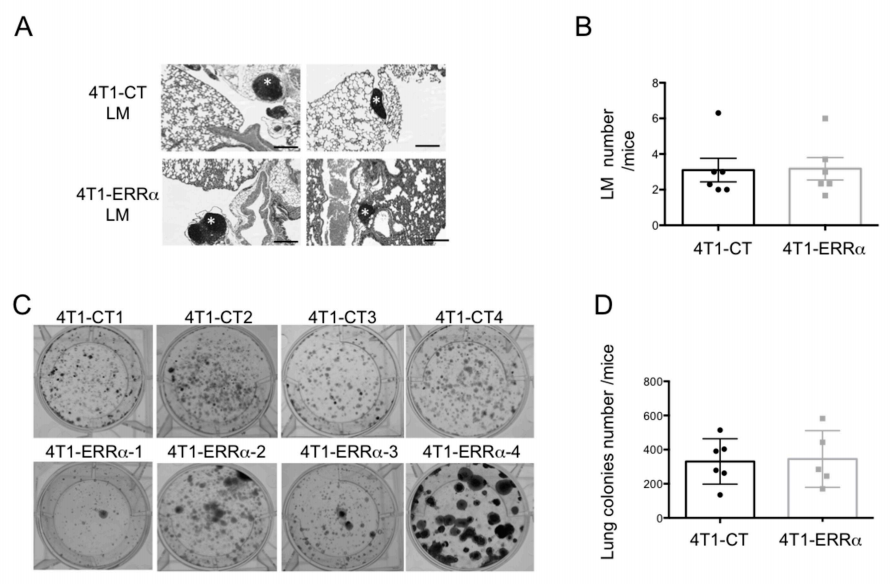
Fig2:晚期乳腺癌细胞中ERRα的过表达对肺转移的发生没有影响
图2 A:细胞注射第15天HE染色后小鼠肺的组织学分析。转移灶用* (B)图表示3个不同深度的代表性切片上的肺转移的癌细胞计数。
图2 C-F:(C和E)压碎来自用于定量骨转移的同一只小鼠的肺,将释放的细胞培养2周。肺转移菌落的代表性图片和(D和F)是说明所有小鼠形成的肺转移菌落数量平均值的图表。
图2 G:显示了2周后在肺转移细胞集落ERRα的平均表达。半定量PCR对n=3只动物进行3个重复的PCR,并对核糖体蛋白基因L32进行归一化。
考虑到4T1细胞也定居在肺中,作者分析了ERRα表达对LM发育的影响。结果与骨骼相反,从肺中提取的LM数量和BCa菌落数量均与4T1细胞中ERRα的表达水平无关。(A-F)但是与对照组相比,4T1-ERRα注射组中观察到了LM中的ERRα过表达。
结合图1、图2的结果,揭示了乳腺癌细胞中ERRα的过度表达阻止了它们在骨骼中的生长,并提示了乳腺癌中ERRα的表达可能会影响骨骼微环境,从而阻止骨转移进展。
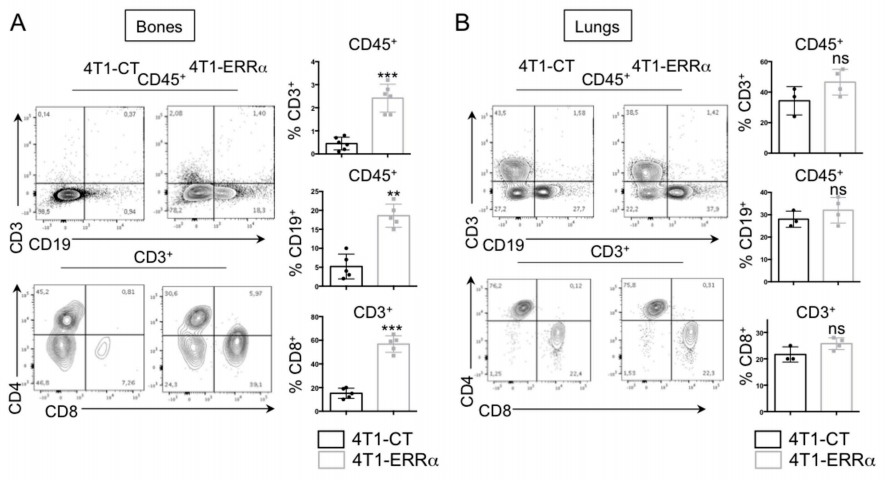
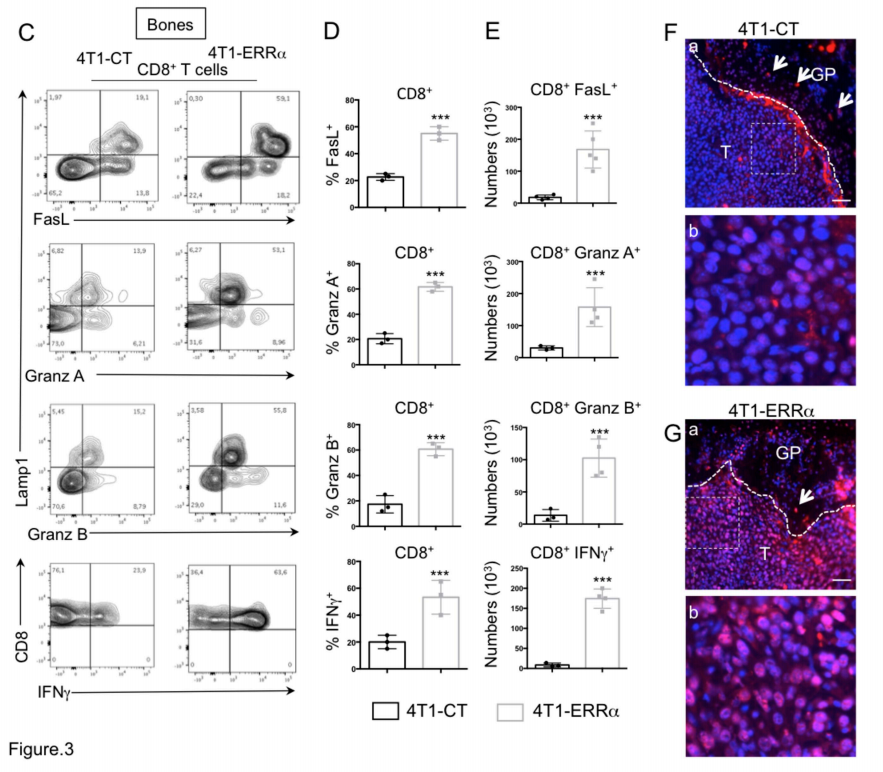
Fig3:晚期乳腺癌细胞中ERRα的过表达促进CD8 + T细胞毒性作用
从接种了4T1-CT或4T1-ERRα细胞的小鼠(n = 4)的转移腿(骨头)(A,C,D-F)或肺(B,C)制备细胞悬液。
图3 A-B:CD45 +造血细胞的流式细胞术等高线图,显示了T细胞(CD3 +),B细胞(CD19 +)和CD4 / CD8 T细胞的比例,以及代表骨骼中细胞百分比的图(A)和肺部(B)。
图3 C-E:流式细胞仪等高线图说明了CD8 + T细胞中FasL(细胞凋亡因子),LAMP-1(溶酶体关联膜蛋白),粒酶A和B(毒细胞检测因子)以及IFN-β(肿瘤坏死生长因子)的产生。(D)图形显示细胞百分比,(E)显示其绝对数。
图3 F-G:TUNEL分析后表达骨的4T1-CT或4T1-ERRα切片的荧光显微照片以及虚线矩形的放大图。DAPI染色后,凋亡细胞显示为红色,细胞核显示为蓝色。(G,H)比例尺=50μm,T:肿瘤,GP:具有凋亡性肥大性软骨细胞的生长板,由白色箭头表示。
将接种了4T1-C和4T1-ERRα细胞的小鼠的腿和肺制备细胞悬液。通过流式细胞仪检
测B细胞、T细胞、毒性、炎症因子、凋亡等指标的差异。结果显示,ERRα在BCa细胞中的表达会影响T细胞在骨骼中锚定后的稳态。与对照组相比,ERRα处理组发现明显的细胞凋亡。
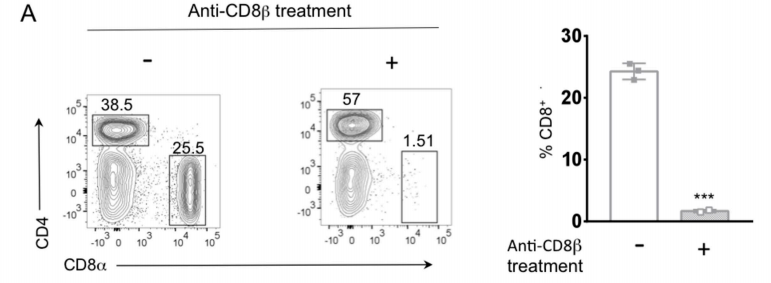
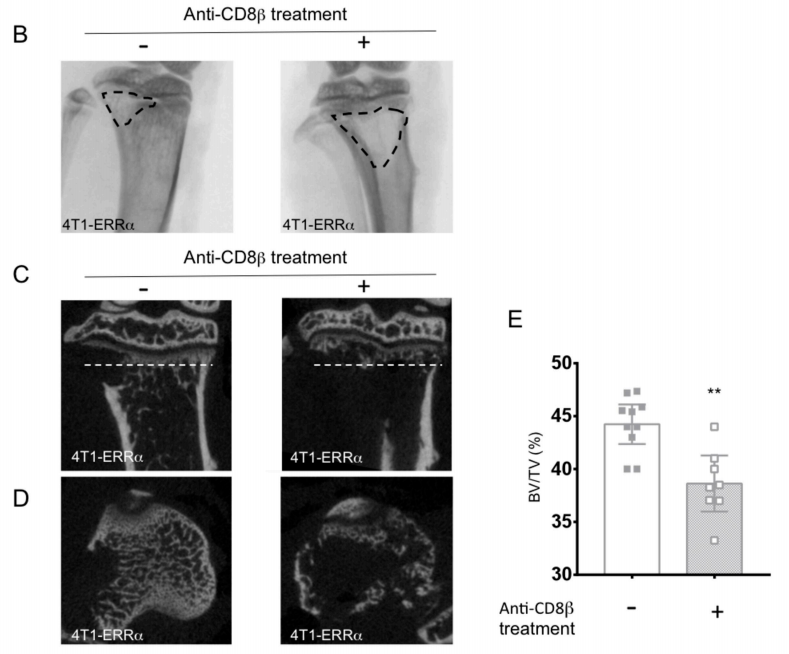
Fig4:CD8+ T细胞消耗恢复4T1-ERRα骨转移进展
图4 A:流式细胞术分析证实加入cd8抗体后,骨中CD8+T细胞缺失。
图4 B:拍照显示4T1-ERRα细胞接种18天后溶骨性病变情况。溶骨区用虚线划分。
图4 C-E:三维microCT重建胫骨的代表在矢状部分(C)和横截面(D)骨沿平面切割。(E)中的虚线所示图表说明的意思是骨体积/组织体积。
结果表明,ERRα在BCa细胞中的表达会影响CD8 + T细胞的稳态,并增加其在骨骼中的抗肿瘤细胞毒性程序,从而控制肿瘤的进展。
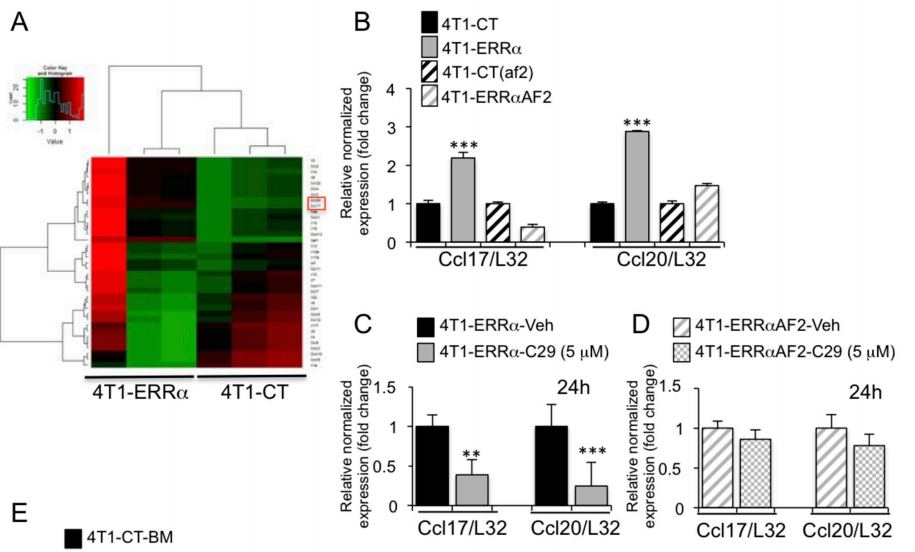
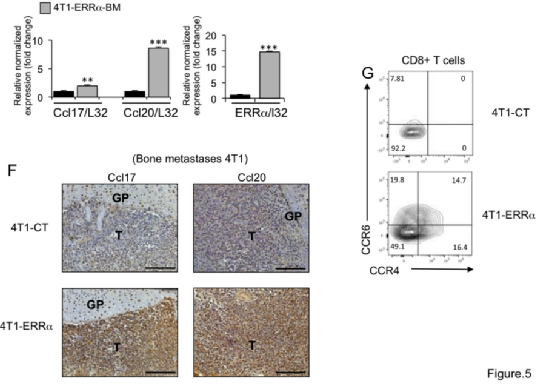
Fig5:ERRα在晚期乳腺癌细胞中上调Ccl17和Ccl20
图5 A:细胞因子、趋化因子和生长因子mRNA在4T1- ERRα细胞和4T1-ct细胞中的表达,与Ppia、Actb和Rplp0的表达对照
图5 B-D:为对3个重复样本进行RT-PCR并对核糖体蛋白基因L32进行归一化后的相关基因表达情况
图5 E:分析了患有4T1-ERRα和4T1-CT病变的小鼠(n=3)粉碎骨骼后获得的肿瘤细胞集落,并在4周内培养
图5 F:4T1-ERRα和4T1-CT细胞定植的骨切片上Ccl17和Ccl20的免疫染色。T:肿瘤,GP:生长板。
图5 G:流式细胞仪等高线图显示了CCR4和CCR6在4T1-ERRα细胞或4T1-CT细胞定植的骨CD8+T细胞上的表达。
结论:通过生信分析发现ERRα在晚期乳腺癌细胞中可上调下游Ccl17和Ccl20的表达,后续通过QPCR和免疫组化验证。
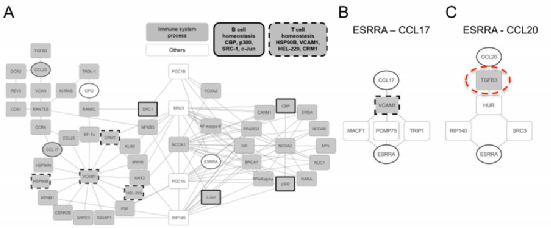
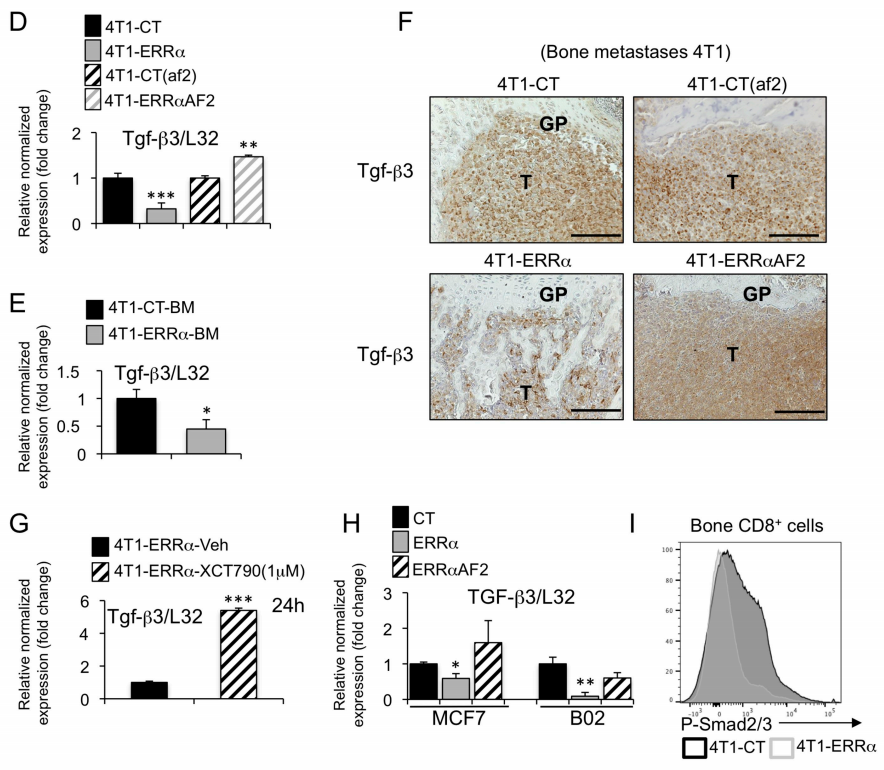
Fig6:ERRα在晚期乳腺癌细胞中上调Ccl17和Ccl20
图6 A:基于涉及免疫系统过程的蛋白质的基因本体学联盟提取的信息覆盖最小网络(包含101种蛋白质),并创建“特定于对肿瘤的免疫应答的最小网络”(包含52个蛋白质)
图6 B-C:通过对串扰子的系统最短路径定义,确定了ESRRA潜在的新调控因子VCAM1、MACF1、HUR和TGF-β3。
图6 D:分析4T1-ERRα、4T1-ERRα-AF2、4T1-CT和4T1-CT(AF2)细胞
图6 E:分析了患有4T1-ERRα或4T1-CT病变的小鼠(n = 3)粉碎骨骼后获得的肿瘤细胞集落,并在4周内培养
图6 F:Tgf-β3在4T1-ERRα;4T1-CT;4T1-CT(af2);4T1-ERRαAF2细胞定植的骨切片上的免疫染色。
图6 G:用反向激动剂XCT-790将4T1-ERRα细胞培养24小时后TGF-β表达量
图6 H:对MCF7和B02克隆的mRNA进行RT PCR。显示了每个MCF7克隆的三种不同培养物的TGF-β3平均值
图6 I:流式显示了4T1-ERRα细胞或4T1-CT定植的骨CD8+ T细胞中SMAD2/3的磷酸化。
基于创建的“特定于对肿瘤的免疫应答的最小网络”(包含52个蛋白质),对串扰子的系统最短路径定义,确定了两个新的ESRRA(ERRα)-CCL17或ESRRA-CCL20相关的调节剂:VCAM和TGF-β 3。结果表明,ERRα的过表达抑制了BCa中TGF-β3的表达,因此可以防止BCa BM在免疫细胞中产生由TGF-信号激活提供的免疫抑制微环境。
整体结论如下:
1.ERRα在BCa细胞中的表达抑制骨转移后的骨溶解;
2.BCa细胞ERRα的表达影响骨中的T细胞的稳态;(募集T细胞)
3.ERRα表达导致BCa细胞中CCL17和CCL20的上调;
4.ERRα的过表达抑制了BCa中TGF-β3的表达,因此可以防止BCa BM在免疫细胞中产生由TGF-信号激活提供的免疫抑制微环境。
