

当lncRNA遇到m6A修饰
 2021-10-12 14:27:20
2021-10-12 14:27:20
来源/作者:普拉特泽生物-医学整体课题外包
因为这周看文献恰好瞄到一篇今年6月发表在oncogene上的研究,主题是关于lncRNA调控大名鼎鼎的m6A修饰。鉴于m6A的名声在外,我觉得非常有必要写这篇文献的解读作为lncRNA摆脱miRNA专题的补充。那么,开始学习吧~
说起m6A(N6-methyladenosine)修饰,确实是最近几年国自然的香饽饽。2018年国自然批准的项目中,m6A相关的研究多达65项,相比2017年翻了3倍;而到了2019年,m6A项目达到179项,比2108年又翻了一倍多。其实,早在1974年,m6A就被研究者检测到(Desrosiers et al. 1974, Perry & Kelley 1974),但由于缺乏检测mRNA中m6A位点的方法,研究人员无法识别包含m6A的单个RNA,研究者对m6A作为mRNA调控模式的兴趣很快消退。MeRIP-Seq最近技术的进步使得对m6A残基的全转录组鉴定成为可能,这使得这一生物学标记成为新的研究热点。
我们先来简单了解一下m6A修饰的过程。m6A修饰指的是RNA上的腺苷酸(A)的第六位N发生甲基化。参与m6A的蛋白可以分为writers,erasers和readers三类,其中writers往核苷酸上添加上甲基,erasers去掉核苷酸上的甲基,readers则是能够识别带有甲基修饰的核酸序列。通过下面这张图我们可以更好地了解这三者是怎么行使功能的。
可以看到,m6A writer 复合物 (RBM15/15B-WTAP-METTL3-METTL14)和m6A eraser (ALKBH5)主要定位在细胞核内。因此,m6A对mRNA的任何动态调控都会在mRNA输出之前发生在细胞核中。在细胞核中的m6A“印记”本质上是不可改变的,并决定了mRNA在细胞质中的命运。在细胞核中,m6A可以被m6A reader识别(YTH蛋白DC1)。在细胞质中,m6A可以被YTH蛋白DF1、DF2和DF3的识别。
好了,了解了m6A的基本情况,我们来看看这篇文献是怎么让lncRNA在中间插一jio的。(LN4C92 promoting METTL14-mediated m6A methylation in breast
cancer cell proliferation and progression,oncogene,IF:7.9,涨分了)
我们先通过机制图来了解一下全文的大概思路。在乳腺癌细胞中,一条思路(支线)是,LNC942上调writer复合物组成蛋白之一的METTL14的 mRNA稳定性,使得METTL14蛋白表达升高。另一条思路(主线)是,LNC942与METTL14蛋白特异结合(+176 - +265),增加METTL14的甲基化酶活性,上调下游靶点CXCR4、CYP1B1 m6A甲基化水平,进而增强CXCR4、CYP1B1的mRNA稳定性和表达。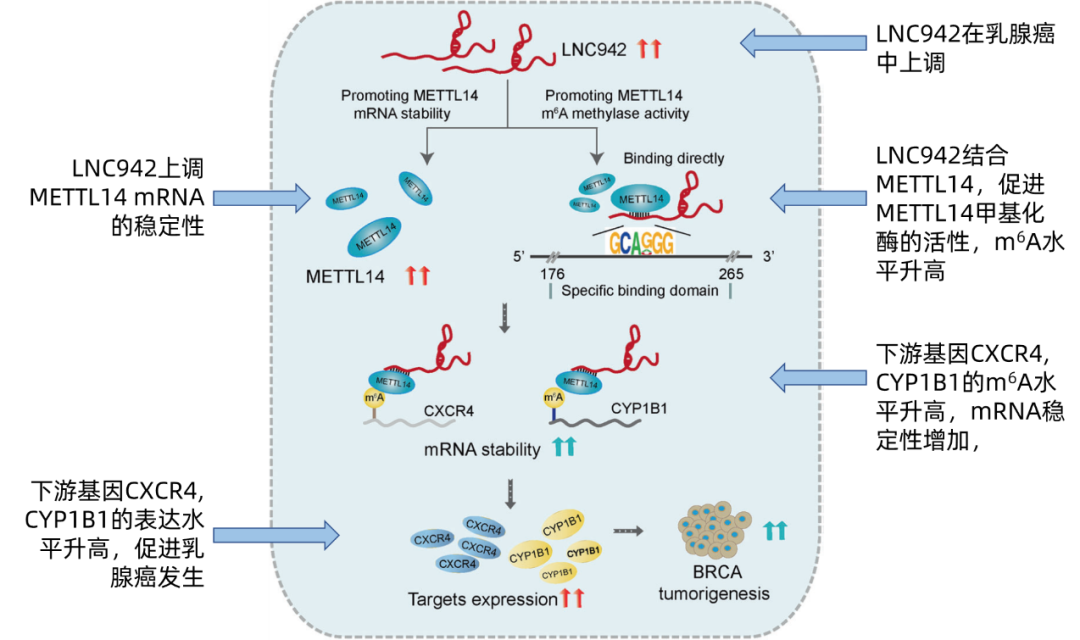
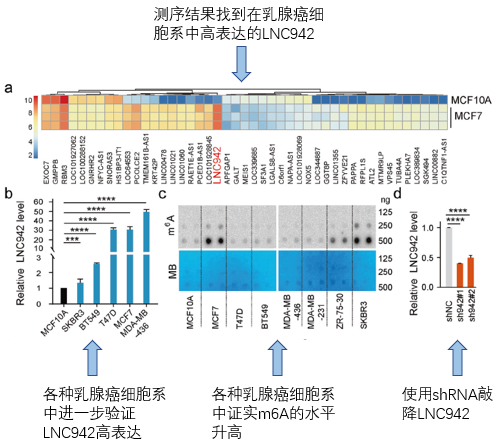
接下来我们看看具体的结果。作者先是在正常乳腺细胞系(MCF10A)和乳腺癌细胞系(MCF7)中进行测序得到差异表达基因,找到了LNC942这个高表达的lncRNA(fig1a),同时在多种乳腺癌细胞系中进一步验证了LNC942的高表达(fig1b)。然后,通过starbase这个综合性的预测网站,作者发现LNC942可能能够与许多m6A相关的蛋白结合。所以在fig1c中,作者通过m6A dot blot assay验证了m6A在各乳腺癌中的水平,发现在MCF7和SKBR3细胞中表达最高。然后,通过shRNA构建LNC942敲低的细胞系(fig1d)。

![]()
![]()
接上图,作者发现敲降LNC942后,能够显著降低METTL14这个m6A writer复合物中的组成之一的表达(fig1e)。在组织水平,通过ISH, IHC, qPCR,验证了LNC942,m6A,METTL14的表达在乳腺癌中升高(fig1f,fig1g)。最后,使用相关性分析,验证了LNC942与m6A以及METTL14之间存在正相关(fig1h)。注意:在临床水平中验证你的关键分子A和B是否存在相关性是非常重要的证据。如果没有数目可观的临床样本,可以借助TCGA数据库来进行分析。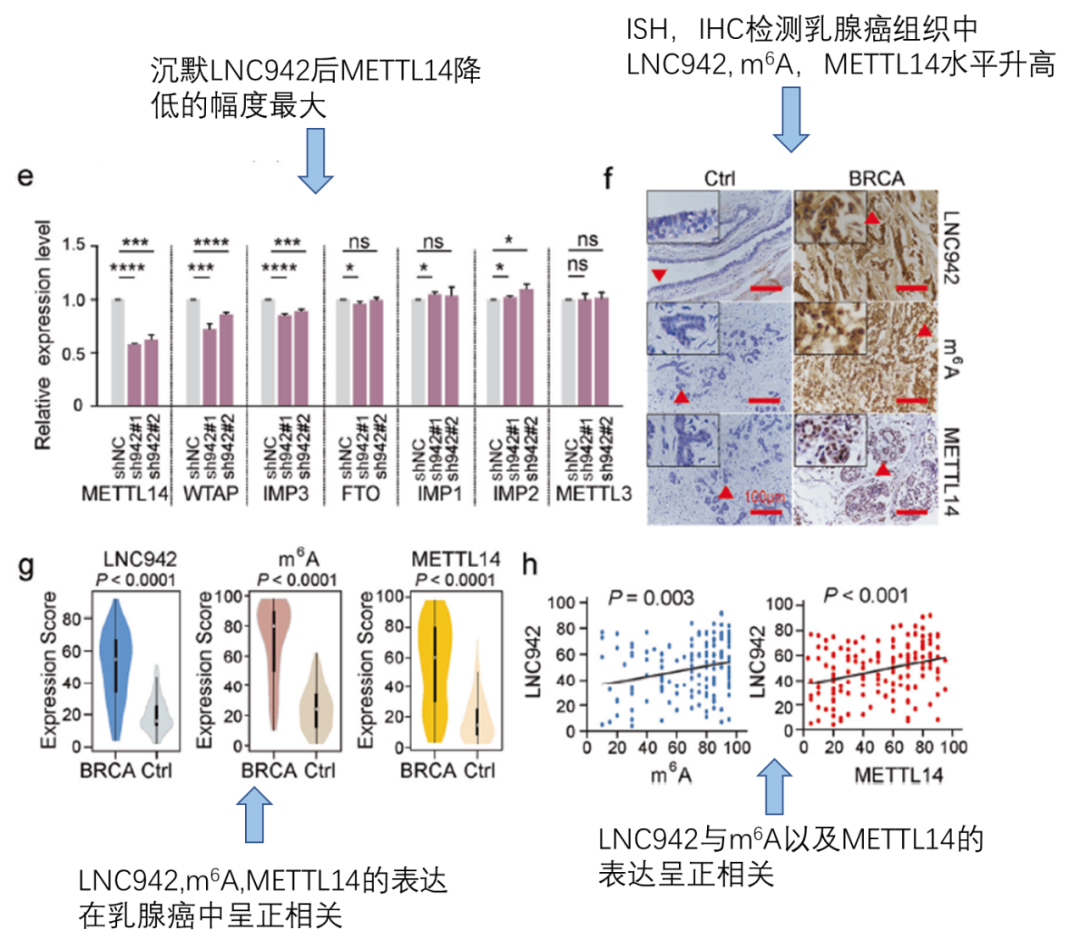

接下来作者从两条线验证了LNC942对m6A的调控,其中一条是直接调控METTL14的mRNA的稳定性。关于作者通过qPCR以及WB验证沉默LNC942能够抑制METTL14的mRNA和蛋白水平的结果由于篇幅的关系就不展示了,我们还是来看核心机制的验证。在fig2f中,通过加入转录抑制剂处理细胞,发现细胞内残留的METTL14随时间减少(降解),而沉默LNC942能够加速mRNA降解的速度。另外,m6A dot blot assay实验验证了LNC942沉默能够降低细胞整体的m6A水平(fig2g)。其实我们可以看到,作者只是比较基础地验证了LNC942能够维持METTL14的稳定性,但是对于中间的具体的机制是怎么样的,可能由于只是一条旁支的非核心机制路线,并没有作深入的探讨。结合我们之前推送的lncRNA与RBP来看,LNC942很可能也是通过结合某种RBP来调控RBP对于mRNA的稳定性的影响。
(相关阅读:让你的lncRNA摆脱miRNA的束缚(上))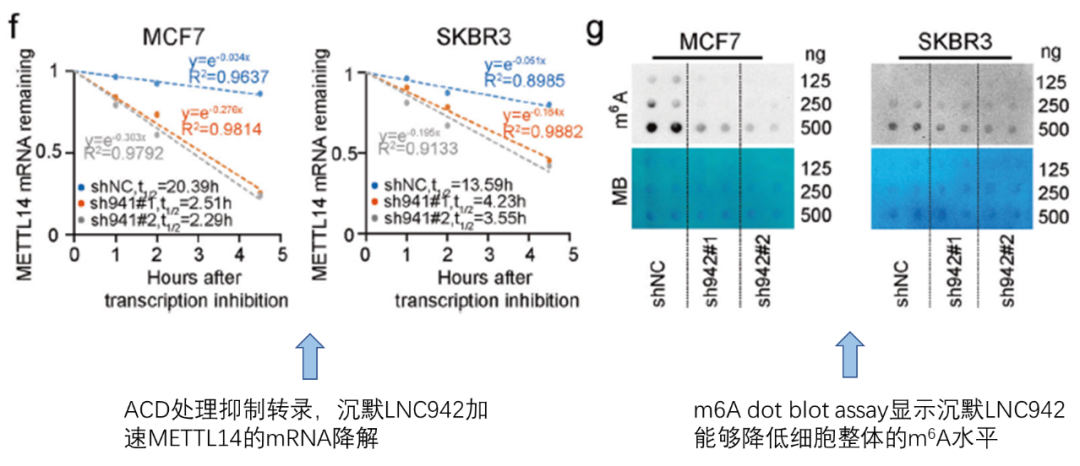

我们接下来看作者怎么验证本文的核心机制,也就是LNC942影响METTL14的甲基化酶活性,作者先是通过ISH和IF验证了LNC942与METTL14的共定位(fig4g),并通过RNA pull down验证了LNC942与METTL14的结合(fig4h),这也是研究lncRNA与蛋白相互作用的基本方法。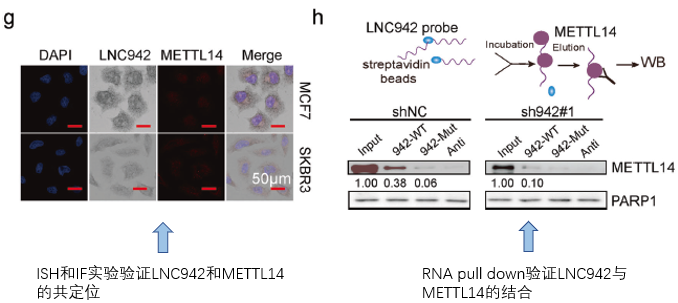

接下来是寻找下游受m6A修饰调控的靶基因,且这些靶基因要与肿瘤以及LNC942相关。通过KEGG分析列出十种可能与LNC942表达相关的细胞功能,其中两种与肿瘤的发生有关(fig5a)。通过对这两种细胞功能相关的候选基因进行m6A位点预测,发现CXCR4和CYP1B1具有高可信度的m6A修饰位点(fig5b)。接下来,作者通过测序结果,和qPCR验证了CXCR4以及CYP1B1在乳腺癌细胞系中表达升高(fig5c,fig5d)。又通过WB和qPCR验证了沉默LNC942会降低CXCR4以及CYP1B1的表达(fig5e,fig5f)。最后,由于m6A修饰会提高mRNA的稳定性,作者通过mRNA降解实验发现沉默LNC942会加速CXCR4和CYP1B1的mRNA降解(fig1g)。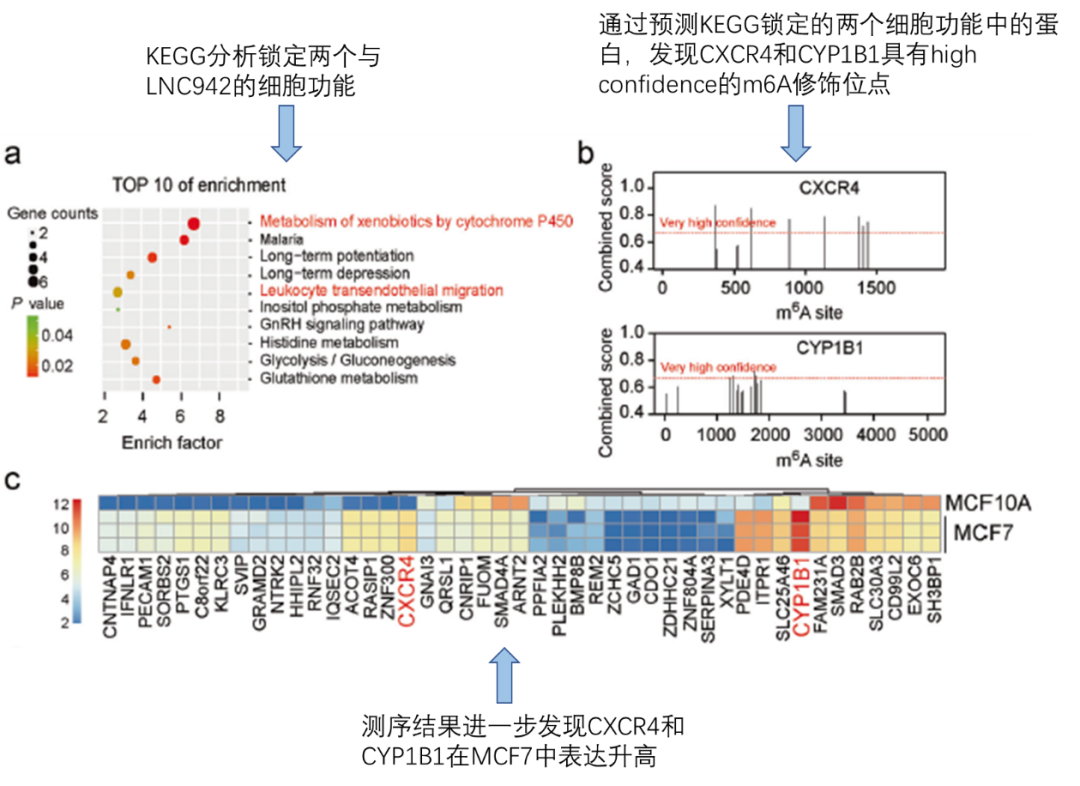
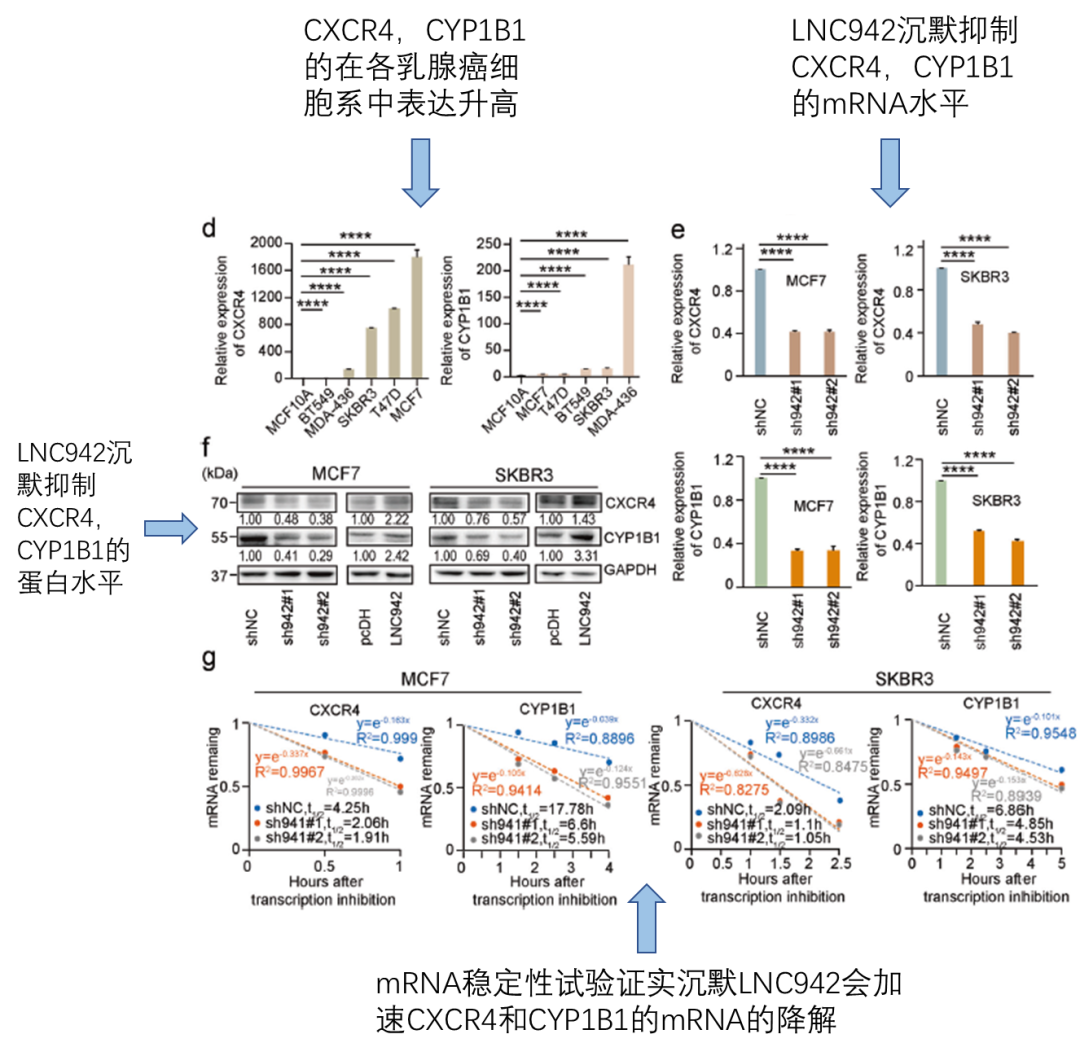

到这里,作者得到了结论,CXCR4和CYP1B1可能是LNC942介导的METTL14调控的m6A修饰的新的候选直接靶点。但是,是不是感觉少了点什么呢,感觉少了点什么就对了?这里作者缺少了对于CXCR4和CYP1B1的mRNA的m6A甲基化水平的检测。此检测使用的方法是m6A RNA免疫沉淀(m6A RIP),与一般RIP的操作相同,使用m6A的抗体得到RNA后,进行qPCR检测。
虽然这个实验还是挺关键的,但是觉得这也不影响这是一篇毕竟经典的关于lncRNA调控m6A的范文。在后续的结果里,作者也通过回复实验,验证了过表达METTL14能够逆转沉默LNC942对CXCR4, CYP1B1,m6A水平,以及肿瘤表型的影响,证实LNC942确实通过METTL14发挥作用。我们可以跟着思路图复习一遍本文的套路。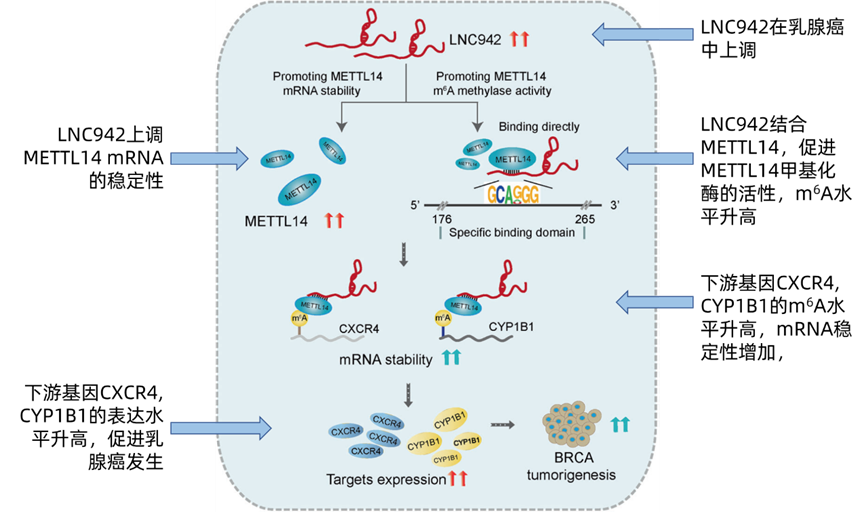
关于lncRNA与m6A的技术总结
1. 核心验证内容:
① lncRNA对总m6A以及下游靶基因(CXCR4, CYP1B1)水平的影响
② 对下游靶基因的mRNA(CXCR4, CYP1B1)稳定性的影响
③ 与m6A修饰相关蛋白(METTL14)的结合。
2. 除了可以从lncRNA调控m6A入手,也有很多从m6A调控lncRNA
