给大家总结了一下普拉特泽生物常用qPCR加样的布板方式,可以尽可能的减少误差
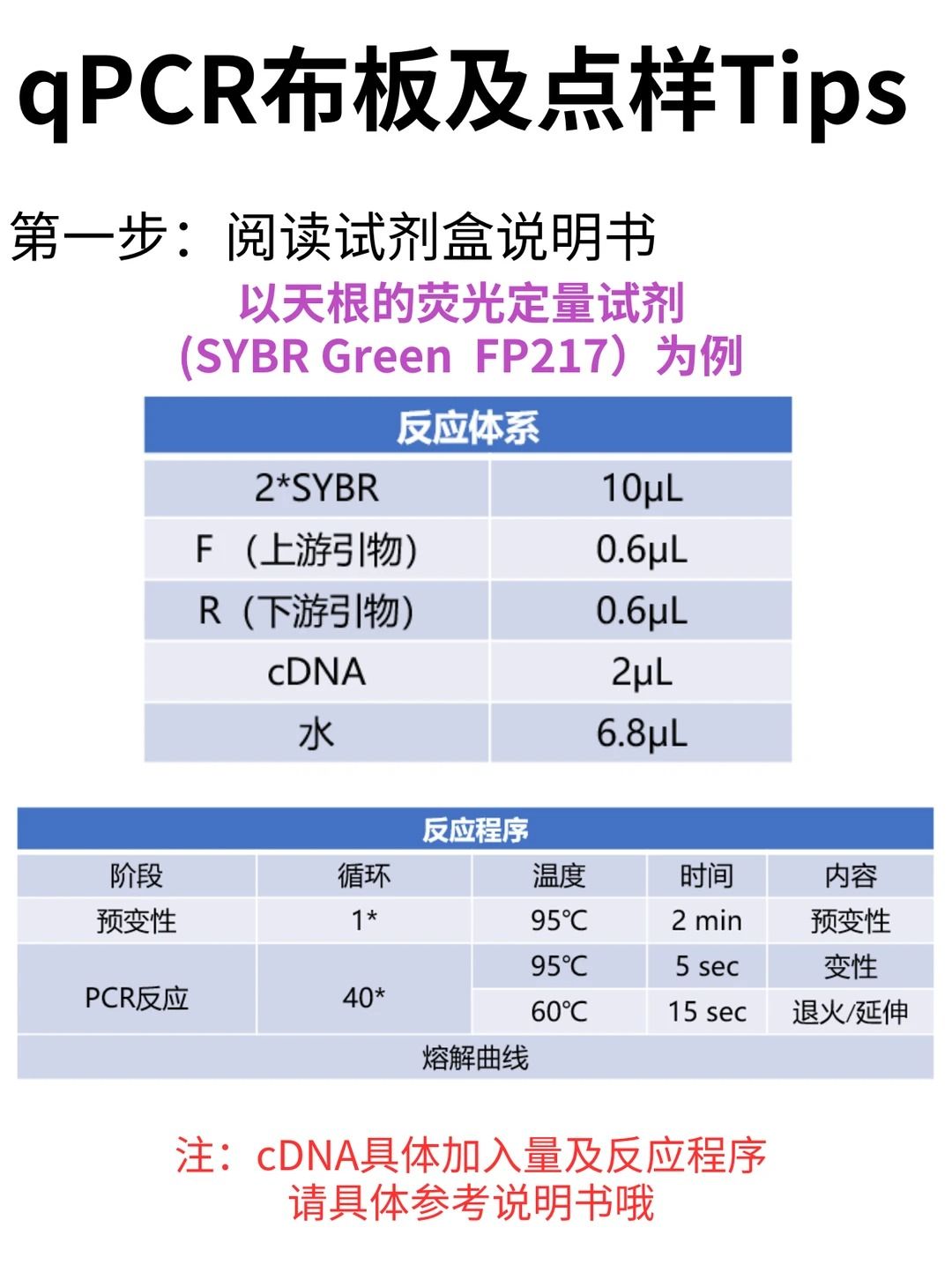
取出跑qPCR的试剂盒,冰上融化,cDNA 稀释5-10倍(具体稀释倍数大家参考说明书)
实时荧光定量 PCR(qPCR)作为分子生物学领域定量分析核酸的核心技术,其结果的准确性、重复性与孔板设计及加样操作直接相关。孔板设计的核心目标是通过合理规划样品、目的基因与技术重复的排布,消除实验误差(包括系统误差与随机误差),确保数据的统计学可靠性。其中,技术重复设置是关键环节 —— 通过对同一样品的同一目的基因进行多次平行检测(常规为 3 次重复),可有效降低加样误差、反应体系不均一等随机因素对结果的影响,为后续 Ct 值分析、熔解曲线验证及相对定量计算(如 2⁻ΔΔCt 法)提供可靠的数据基础。
孔数计算的逻辑推导与实例验证
(一)计算逻辑的科学依据
孔数的确定需覆盖 “样品维度 - 基因维度 - 重复维度” 的全要素,其核心公式推导如下:
单一目的基因的检测孔数 = 样品数量 × 技术重复次数(n=3,符合生物统计学中平行重复的最低要求,可通过标准差分析评估数据离散度);
总检测孔数 = 单一目的基因的检测孔数 × 目的基因总数(含内参基因)。
该公式的本质是实现 “每个样品的每个基因均获得独立且可重复的检测数据”,避免样品交叉污染或重复不足导致的数据可信度不足。内参基因(如 GAPDH、β-actin)作为标准化参照,需与目的基因遵循相同的重复设置原则,以确保样品间 RNA 提取效率、逆转录效率及 PCR 扩增效率的校准准确性。
(二)实例拓展与验证
以 “8 个样品 + 5 个目的基因 + 1 个内参基因” 为例,按上述逻辑计算总孔数:
总孔数 = 样品数(8)× 基因总数(5+1=6)× 技术重复数(3)= 8×6×3=144 孔。
该结果适用于 96 孔板(需分 2 块板,每块板设置阴性对照与空白对照各 3 孔)或 384 孔板(单块板即可完成,预留孔位用于梯度验证)。若减少技术重复数至 2 次,虽可降低孔数(8×6×2=96 孔),但会导致数据变异系数(CV)升高,建议仅在样品量有限且预实验验证重复性良好时采用。
三、孔板布局的优化原则
避免边缘效应:qPCR 反应中,孔板边缘孔的温度传导效率与中心孔存在差异,易导致 Ct 值偏移。建议将样品孔集中在板的中心区域,边缘孔用于设置阴性对照(NTC,无模板对照)、阳性对照(PC,已知阳性模板)及空白对照(Blank,仅含反应液)。
重复孔相邻排布:同一样品的同一基因重复孔应相邻设置,减少移液器移液距离导致的加样误差,同时便于后续数据合并分析。
基因与样品分组明确:可按 “行 = 基因,列 = 样品” 或 “行 = 样品,列 = 基因” 的方式布局,例如:第 1-3 列设置样品 1 的 6 个基因(每个基因 3 个重复),第 4-6 列设置样品 2 的 6 个基因,依次类推,避免不同基因或样品交叉混淆。
对照孔均匀分布:阴性对照与空白对照应均匀分布在板中,而非集中于同一区域,以全面评估整个反应体系的污染情况。
四、加样操作的规范流程与注意事项
(一)加样顺序与体积控制
优先配制混合反应液(含酶、引物、探针、缓冲液等),按总孔数 + 10% 的余量计算体积,避免因移液损耗导致样品不足。
采用 “先加混合液,后加模板” 的顺序:向每个孔中加入等量混合反应液(如 10μL / 孔),再加入模板(如 2μL / 孔),避免模板提前暴露于高温或酶活性环境中。
移液时使用带滤芯吸头,避免交叉污染;每加完一个样品或基因后更换吸头,加样体积误差需控制在 ±0.5μL 以内(对于 20μL 体系)。
(二)防污染与反应均一性保障
1. 加样前将模板与混合反应液充分混匀(模板轻柔颠倒混匀,混合液涡旋混匀后短暂离心),避免局部浓度不均。
2. 加样后对孔板进行短暂离心(3000rpm,1min),使液体汇集于孔底,避免气泡产生(气泡会影响荧光信号检测)。
3. 全程在冰上操作,减少酶活性丧失;加样完成后立即密封孔板(使用光学密封膜),避免蒸发或污染。
(三)特殊情况处理
若样品为 RNA(直接进行 RT-qPCR),需严格控制 RNase 污染,所有耗材(吸头、离心管、孔板)均需无 RNase 处理,加样过程中避免说话或呼气靠近样品。 五、总结 qPCR 孔板设计与加样操作是实验成功的基础,其核心逻辑是通过 “全要素覆盖的孔数计算”“误差最小化的布局优化” 及 “标准化的加样流程”,确保数据的准确性与重复性。实际实验中,需根据样品量、基因数量、仪器型号(96 孔板 / 384 孔板)灵活调整计算方式与布局策略,同时重视对照设置与污染防控,为后续定量分析提供可靠的实验基础。
具体布板和点样方法,其实没有固定范式,大家有好的加样点样技巧也欢迎分享~


如果您想要多的更多相关信息和帮助,可以联系普拉特泽生物技术有限公司


 2025-12-16 14:32:19
2025-12-16 14:32:19



