

蛋白原核表达-从原理到实操超详细教程【蛋白表达】
 2025-09-05 10:39:38
2025-09-05 10:39:38
来源/作者:普拉特泽-生物医学整体课题外包平台
宝子们,做生物实验的一定对蛋白原核表达不陌生!今天噗啦噗啦实验室就来给大家奉上一份超全攻略,从核心原理到操作步骤,手把手带你玩转蛋白原核表达
一、原核表达核心原理
1.技术本质
通过基因工程手段,将目标基因插入表达载体后导入原核宿主细胞(如大肠杆菌),利用细胞内的转录和翻译机制,实现外源蛋白质的高效合成。这一技术通过重组表达系统的构建,为蛋白质的生产、结构解析和功能研究提供了关键工具。
2.应用场景
①蛋白质表达技术在生物医学领域应用广泛:
②纯化制备:获取高纯度蛋白质,用于生物化学分析或结构生物学研究;
③亚细胞定位:揭示蛋白质在细胞内的分布规律,解析其功能机制;
④结构域分析:通过分段表达不同蛋白片段,研究结构与功能的对应关系;
⑤功能验证:为体外模拟蛋白质在生理或病理过程中的作用提供实验材料,助力疾病诊疗研究。
3.系统分类
→蛋白质表达系统主要分为原核与真核两大类,其中原核系统包括:
→大肠杆菌表达系统:最常用的原核平台,具有遗传背景清晰、表达效率高、培养周期短(仅需几小时)、抗污染能力强、技术成熟且成本低廉等优势,适用于大多数重组蛋白的表达;
→芽孢杆菌表达系统:分泌能力强,产物易于纯化,适合需要分泌表达的蛋白质;
→链霉菌表达系统:常用于抗生素相关酶的生产,利用其天然代谢特性合成特定功能蛋
4.大肠杆菌系统优势
大肠杆菌作为原核表达的首选宿主,具备以下核心优势:
基因组信息研究透彻,便于基因工程操作;
短时间内可大量合成目标蛋白,满足实验与生产需求;
培养条件简单(如 LB 培养基),适合大规模放大培养;
实验技术标准化程度高,操作流程成熟易掌握;
菌株和质粒资源丰富,可根据蛋白特性灵活选择表达载体。
二、原核表达标准化操作流程
1.转化
将构建好的重组表达载体转入感受态 BL21/DE3菌株,常用热激法(42°C短暂处理)或电转化法,优化操作以确保高效转化,筛选出含有目标基因的阳性克隆。
2.扩大培养
在 500ml 灭菌 LB 培养基中加入对应抗性抗生素(终浓度 50-100ug/ml),挑取单菌落接种后于 37°C摇床培养至菌液浓度达到诱导标准(通
常 OD<sub>600</sub>为 0.6-0.8)
3.诱导过夜
取 100m 诱导前菌液(标记为 Pre-l)保存作为表达基线对照
剩余菌液中加入IPTG(终浓度 0.1-0.5mM),18°C过夜诱导,促使目标基因表达。
4.菌体收集
诱导后的菌液经 4000rpm 离心 25 分钟,弃上清后,用 30-35mI Ni-A 缓冲液(适用于 His 标签蛋白)重悬菌体,转移至离心管备用。
5.超声裂解
冰浴条件下,用超声波破碎仪裂解菌体(功率200W,工作周期3秒开/3秒停,总时长9分钟,分3次操作),随后通过 Bradford 法检测裂解液中的总蛋白浓度,验证裂解效果
6.离心分层
裂解液于 4°℃、4000rpm 离心 25 分钟,分离出上清液(SUP,含可溶性蛋白)和沉淀(PPT含包涵体或细胞碎片),分别保留用于后续分析。
7.镍柱纯化
▲平衡:先用高浓度咪唑的 Ni-B 缓冲液(如400mM)冲洗镍柱去除杂质,再用低浓度咪唑的 Ni-A 缓冲液(如 20mM)平衡柱子;结合:将上清液与镍柱填料混合,4°C孵育1-1.5 小时,使 His 标签蛋白与镍离子充分结合;
▲洗杂与洗脱
过柱后收集穿流液(UB),检测未结合的杂蛋白,评估结合效率;
用 Ni-A 缓冲液洗去杂蛋白(收集 WS样本),再用 Ni-B缓冲液洗脱目的蛋白(收集E样本),通过 Bradford 试剂监测至无杂蛋白释放。
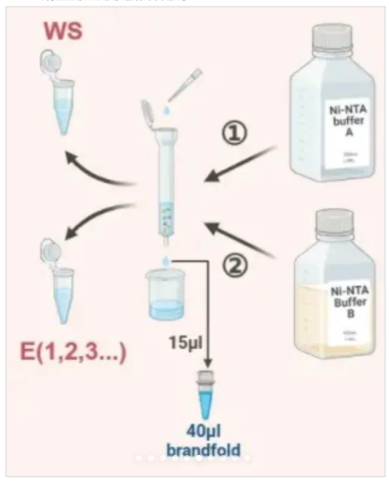
8.变性与电泳将目的蛋白样本(E)、Pre-1、SUP、PPT.UB、WS 等分别加入 Loading Buffer,95°C变性 10 分钟,使蛋白完全解链,随后进行 SDS-PAGE 电泳(200V,40分钟),分离不同分子量的蛋白条带
9.染色分析
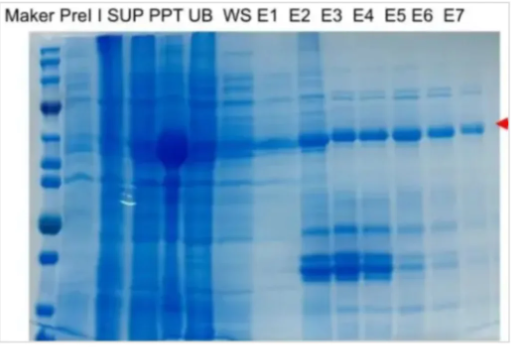
电泳结束后,用考马斯亮蓝染色液对凝胶染色通过微波炉辅助脱色(加热后摇床洗脱),直至清晰显示蛋白条带,对比 Marker 判断目标蛋白的分子量和表达量。
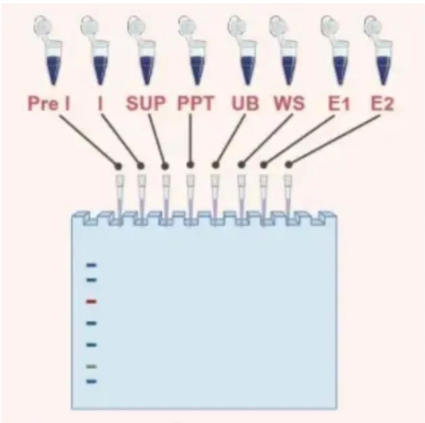
三、关键样本类型与作用
在原核表达实验中,需收集多种样本以评估各环节效果:
Pre-l(诱导前菌液):诱导剂加入前的菌体样本,用于对比诱导前后的蛋白表达基线判断诱导是否有效;
Induced(诱导后菌液):加入IPTG后的菌体样本,验证外源蛋白是否成功表达及表达水平;
SUP(上清液):离心后的可溶性蛋白样本,反映目标蛋白是否以可溶形式存在于细胞中;
PPT(沉淀):离心后的包涵体或细胞碎片样本,提示目标蛋白是否形成不可溶的包涵体,需进一步复性处理;
UB(穿流液):镍柱纯化中未结合的液体,用于检测目标蛋白与镍柱的结合效率及杂蛋白残留量;
WS(洗杂液):洗去杂蛋白的流出液,监测纯化柱是否干净,杂蛋白去除是否彻底
E(洗脱液):最终收集的目的蛋白样本,用于验证纯化后的蛋白纯度和得率。
宝子们,蛋日原核表达虽然复杂,但掌握了这些要点实验就能顺利很多巴!快收藏起来,实验的时候拿出来参考~要是还有问题,随时交流呀:18570028002(微信同号)

