大家好,又和大家见面啦,11月份的分享呢,仍然是与表观遗传有关的课题——苏木化修饰。
那么,目前苏木化修饰在研究领域是一个怎样的情况呢?且让我们从pubmed和国自项目上的数据来了解一下。
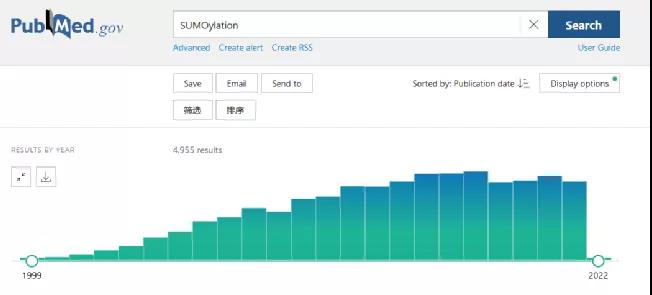
在pubmed数据库中输入“SUMOylation”,文章数量为4955+篇,数量虽然不多,但每年仍然有400篇左右相关文章发表。
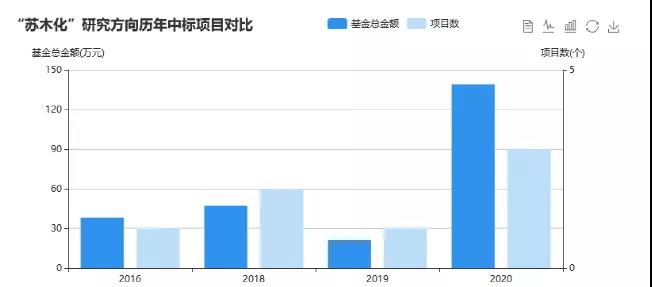
从国自然立项情况来看,每年中标的项目也不多,结合SCI和中标数目来看,做相关课题的科研者还较少,与苏木化相关的领域还有待进一步去开采。
我们今天就来学习一下表观遗传当中这个等待开发的“苏木化修饰”的知识点。苏木化修饰是苏木小体在一系列相关酶(E1活化酶、E2结合酶和E3连接酶)的作用下,通过SUMO的3’端和靶蛋白的赖氨酸残基的ε-氨基之间形成异肽键的结合,调控底物蛋白结构与功能的一种重要的翻译后修饰类型。苏木化在生理及病理过程中扮演着重要的角色,与很多疾病息息相关,如,肿瘤、心血管系统疾病、脑损伤疾病等。所以说,通过两篇文献来get一下这个知识点是非常有必要的呦~
接下来,跟着这次分享的SCI的来一起学习一下苏木化修饰的具体研究思路吧!
文献题目是:SENP1 modulates microglia-mediated neuroinflammation toward intermittent hypoxia-induced cognitive decline through the de-SUMOylation of NEMO.影响因子5.310分,是2021年5月份发表在J Cell Mol Med杂志上的一篇文章。主要研究SENP1通过NEMO去sumoylation从而参与调控小胶质细胞介导的神经炎症引起的间歇性缺氧诱导的认知能力下降。一、海马SENP1的表达谱鉴定为间歇性低氧(IH)损伤的潜在保护因子
mRNA热图显示,IH干预小鼠后,海马中SENP1的表达较常氧干预的小鼠相比显著减少(Fig 1A)。火山图显示,IH处理小鼠海马中SENP1下调而SUMO-1上调 (Fig 1B)。此外,IH处理小鼠组海马区SENP1的表达明显减少(Fig 1C-E)。以上结果表明海马体的SENP1在IH诱导损伤中可能发挥重要作用。

二、IH能激活BV-2细胞的NF-κB通路和炎症反应,SENP1过表达能抵消这些作用
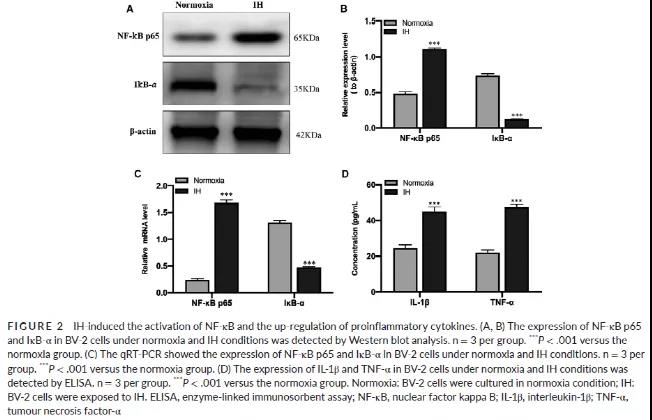
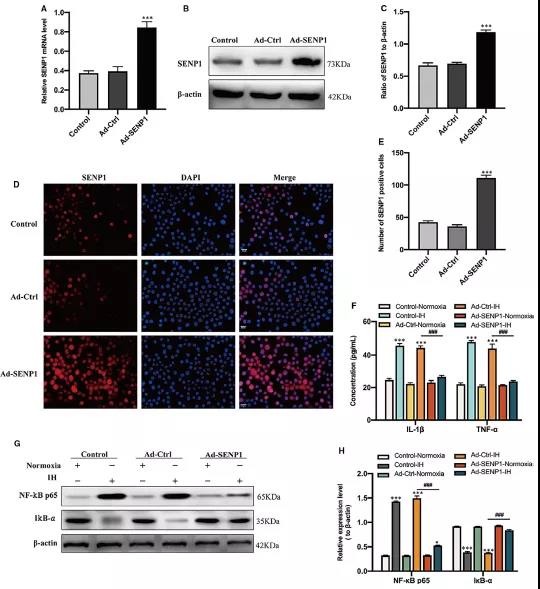
IH干预BV-2细胞后,检测NF-κB通路的蛋白表达情况。与常氧组相比,IH组NF-κB p65明显上调,IκB -α明显下调 (Fig 2A-C),提示IH干预后激活了NF-κB通路。且通过ELISA检测炎症因子IL-1β和 TNF-α浓度在IH干预细胞组显著升高 (Fig 2D)。采用腺病毒感染BV-2细胞成功过表达SENP1 (Fig 3A-E)。过表达SENP1后,能逆转IH促进的炎症因子分泌(IL-1β和TNF-α)(Fig 3F)。另外,IH处理后激活的NF-κB通路,即NF-κB p65表达升高,IκB –α表达降低也被过表达的SENP1逆转 (Fig 3G-H)。以上研究结果说明,IH干预BV-2细胞后能刺激炎症反应和激活NF-κB通路,但过表达SENP1能减弱此过程。

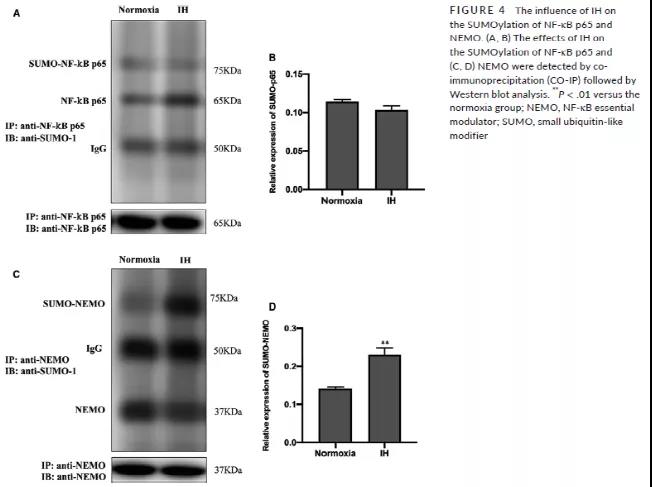
通过Co-IP实验发现,IH干预细胞后,NF-κB p65的苏木化修饰和常氧处理组表达没有明显差异,但NEMO的苏木化表达明显增高 (Fig 4A-D),因此得出,IH显著诱导了BV-2细胞中NEMO的苏木化修饰,而非NF-κB p65的苏木化修饰。
四、过表达SENP1减弱的炎症反应是介导NEMO的苏木化修饰而实现的
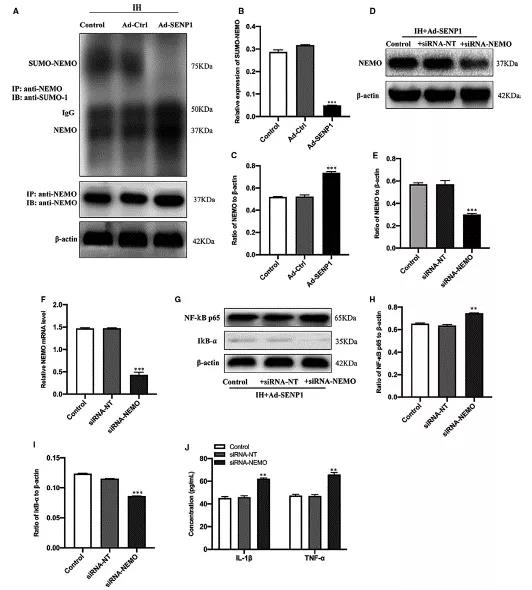
为了寻求SENP1在IH处理的BV-2细胞抑制炎症反应的具体分子调控机制,首先采用Co-IP检测了过表达SENP1之后NEMO的苏木化表达情况。结果显示,IH干预后增高的NEMO的苏木化表达能被SENP1过表达所抵消,也就是SENP1过表达之后能显著抑制了NEMO的苏木化表达,从而提高了NEMO的表达 (Fig 5A-C)。SENP1过表达的IH处理的BV-2细胞被si-NEMO转染后,SENP1过表达对NEMO表达的升高作用被si-NEMO降低 (Fig 5D-F)。另外,发现SENP1过表达对NF-κB通路的失活作用和炎症因子分泌的抑制作用被NEMO敲降所逆转,即si-NEMO敲降后激活了SENP1过表达的IH处理的BV-2细胞中的NF-κB通路和炎症因子分泌(Fig 5G-J)。通过以上回复实验得到,过表达SENP1减弱的炎症反应是通过调控NEMO的苏木化修饰来进行的。

五、在体实验中,敲降SENP1基因后,通过NEMO的苏木化调控抑制小鼠的炎症因子反应
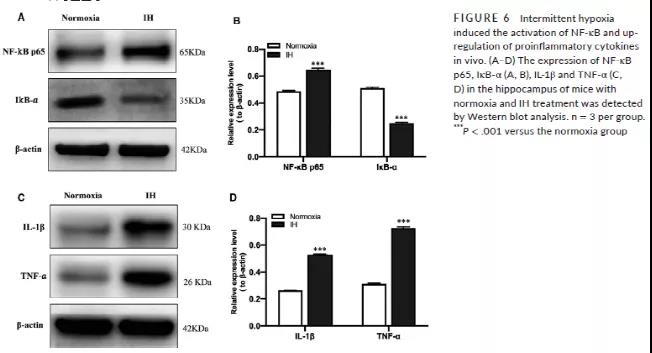
在IH条件诱导后,小鼠海马体组织的NF-κB p65、炎症因子IL-1β和 TNF-α 的表达上调,而IκB-α表达下降 (Fig 6A-D)。采用基因编辑技术敲降小鼠的SENP1基因,并用DNA琼脂电泳和WB验证其效率。野生型小鼠的基因型为纯合子,而SENP1敲除小鼠为突变杂合子 (Fig7A)。突变杂合子小鼠的SENP1基因蛋白表达明显低于野生型纯合子小鼠 (Fig7B-C)。此外,还观察到敲降SENP1基因小鼠组中的NUMO-1基因蛋白表达明显增高 (Fig7B-C),说明在体内实验中,SENP1敲降促进了苏木化修饰。而且,小鼠在经过IH条件处理后,采用Co-IP进一步说明了敲降SENP1后,NEMO的苏木化修饰明显增多,而NEMO的蛋白表达水平却下降 (Fig7D-F)。WB检查了IκB-α、IL-1β和 TNF-α的表达水平,发现在SENP1敲降的小鼠组中,IκB-α表达明显降低,炎症因子表达水平明显升高 (Fig7G-J)。以上结果又一次验证了细胞层面的结果,敲降SENP1基因后,增加NEMO的苏木化修饰,促进炎症反应。

六、SENP1基因敲降后,小鼠在IH干预后认知功能障碍加剧
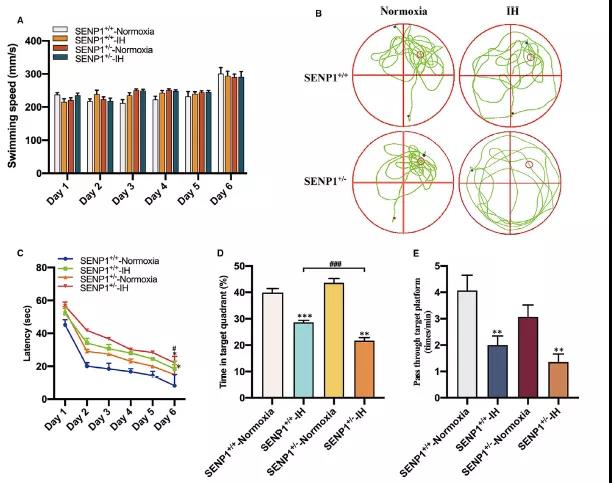
在IH干预前后,通过MWM测试评估小鼠(SENP1敲除和未敲除)的空间定向学习记忆能力,小鼠空间定向的学习记忆能力无显著差异,提示IH和SENP1基因敲除均对空间定向的学习记忆能力没有影响 (Fig 8A)。然而,游泳轨迹结果显示,IH治疗组小鼠在非靶象限停留的时间比常氧治疗组更长,而这一现象在的SENP1敲降小鼠组表现更为明显 (Fig 8B)。另外,IH干预后表现出较长的逃逸潜伏期,而SENP1敲降组在第6天时比野生组表现出较长的逃逸潜伏期 (Fig 8C)。同时,IH组在目标象限的时间百分比和通过目标平台区域的频率均显著降低。值得注意的是,与野生型相比,SENP1敲降组的减少更为明显 (Fig 8D-E)。然而,与野生型相比,SENP1敲降组穿过目标平台区域的频率没有统计学意义 (Fig 8E)。以上结果表明IH损害了小鼠的认知能力,而SENP1敲降进一步恶化了这种损害。
该文献的实验成果在这里就介绍完了,我们再重新捋一遍文章的思路。首先,通过生物学信息分析筛选出目标基因SENP1和苏木化修饰的联系,及小鼠海马区组织SENP1基因的表达情况。其次,IH干预细胞后,SENP1对炎症因子的作用。再次,SENP1对炎症因子的作用背后的机制(调控NEMO蛋白的苏木化)。最后,在体动物SENP1基因敲除小鼠验证细胞层面的结果。
整篇文章思路比较简单,在细胞功能上也只做了对炎症因子的影响。但文章结合了生物信息学分析、细胞实验、基因敲除动物实验对假设做了较完整的验证,证据链充足。涉及的苏木化机制较少,但也明确说明了SENP1能通过调控NEMO的苏木化修饰,从而调控其表达,进而影响炎症因子和NF-κB通路,参与IH条件诱导的认知障碍调节。
在下一次我们还会分享1篇与苏木化相关的高分文献(14分左右),这次未尽兴的朋友们可以继续关注我们下次的文献分享。


 2021-11-23 09:57:21
2021-11-23 09:57:21












