

WB实验检测介绍——检测小鼠组织中GSTM2的表达
 2023-03-17 14:12:46
2023-03-17 14:12:46
来源/作者:普拉特泽-生物医学整体课题外包平台
WB实验检测介绍由普拉特泽生物病理实验平台为大家总结分享。普拉特泽生物为广大科研人员提供长期稳定的实验研究技术服务,本文给大家分享咱们技术员长期总结下来的动物组织WB实验检测。
一、实验目的
利用Western Blot技术检测各样本中目的蛋白的相对含量
二、实验步骤
1.蛋白提取
(1)样本的收集:
细胞:用1 mL生理盐水对离心下来的细胞进行洗涤,同时将其转移至1.5 mL的离心管中。
组织:取适量组织剪碎,研磨匀浆。
(2)按1 mL裂解液加10 μL PMSF (100 mM),摇匀置于冰上。PMSF要摇匀至无结晶时才可与裂解液混合。
(3)根据细胞量的多少,每管细胞加100-500 μL含PMSF的裂解液,于冰上裂解30 min。
(4)4℃下12000 rpm离心10 min。离心后的上清分装转移至1.5 mL的离心管中,用于蛋白定量检测。若不能及时定量蛋白浓度,请置于-80℃保存。
2.蛋白定量及处理(BCA法)
(1)使用时将BCA试剂盒中 Solution A摇晃混匀,根据样品数量,按50体积Solution A加1体积Solution B (50:1) 配置适量BCA工作液,充分混匀后即成淡绿色的工作液。BCA工作液室温24 h内稳定。
(2)将标准品 (1mg/mL BSA) 按0、1、2、4、6、8、10 μL的量分别加入96孔板中,再加入去离子水将所有标准品补足到10 μL。
(3)加1 μL的样品到96孔板中,加去离子水补足到10 μL。
(4)各孔加入200 μL BCA工作液,轻轻用移液器吹打混匀(注意不要产生气泡以免影响读数),37℃孵育30 min。
(5)冷却到室温后,用酶标仪测定A562的吸光度值。
(6)根据标准曲线计算出样品中的蛋白浓度。
(7)蛋白变性处理:蛋白溶液与5×Loading buffer 按照体积比4:1混匀(此时蛋白浓度变成实际检测浓度的0.8倍),置于沸水中煮10min,冷却后进行SDS-PAGE电泳,或储存于-80℃,避免反复冻融。
(8)蛋白浓度的计算公式
举例标曲为:Y=aX+b(Y为OD值,X为测定浓度)
样品蛋白浓度=[(Y-b)/a]×稀释倍数
3. Western Blot
(1)配制分离胶和浓缩胶:根据目的蛋白分子量大小,配分离胶和5%浓缩胶。
蛋白分子量(kDa)分离胶浓度%
10-2515
15-5512
25-7010
35-1008
70-3006
(2)上样:计算含20~80 μg蛋白的溶液体积,即为上样量。用1×Loading buffer 补至每个加样孔的总体积一致。
(3)电泳:浓缩胶电压为80 V,40 min,分离胶电压120 V,30-50 min。溴酚蓝跑至胶底即可终止电泳,进行转膜。
(4)转膜:恒压100V,0.45/0.22 μm PVDF膜。
(5)封闭: 将PVDF膜完全浸没在5% milk-PBST或5% BSA-PBST中,室温轻摇60 min或4℃过夜。
(6)一抗孵育:用5% BSA-PBST稀释一抗,4℃孵育过夜。
(7)洗膜:次日取出PVDF膜,PBST洗膜5次,每次6 min。
(8)二抗孵育:PBST稀释二抗,室温孵育60 min。
(9)洗膜:PBST洗膜5次,每次6 min。
(10)显影:ECL A和B液按体积1:1混合后均匀滴加在膜上,按需求设置曝光时间及曝光类型,开始曝光,曝光结束后保存图片并导出图片。
4.图像分析
用图像分析软件Image J对图像进行灰度分析。
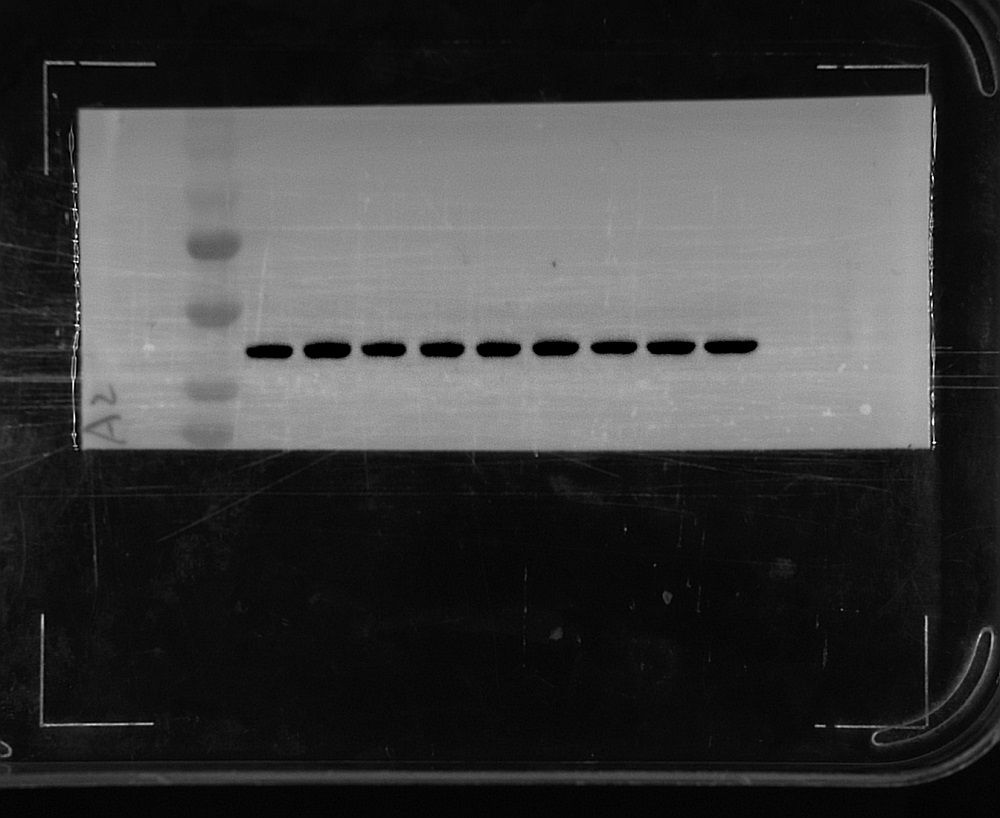
WB实验灰度分析
今天关于WB实验检测介绍就分享到这儿啦~如果您在实验过程中遇到技术问题,或者需要实验外包和代做,可与我们技术老师联系哦:18570028002(微信同号)
