

18分,来看看miRNA与靶基因研究的秀儿!【文献导读】
 2020-12-17 16:18:04
2020-12-17 16:18:04
来源/作者:普拉特泽生物-医学整体课题外包
中国学者俨然已经对“套路式研究”充满排斥。
从热点追逐,到形成套路,再跟风灌水,最后疲倦嘲讽,仿佛是中国学者陷入的研究怪圈。
于是,三五年miRNA、三五年lnc、circRNA,到现在的m6A、外泌体、焦亡、铁死亡...
我们需要它,利用它,又嫌弃它。
要知道,科研本没什么热点冷点,最终都是大道相通,科研拥有着最底层的通用逻辑,即高层次的思维模型。
今天,小编就来带大家看一篇 old fashion的miRNA与靶基因的经典文献,该文发表于Journal of Hepatology杂志,影响因子18.94。

主要讲的是,miR-221-3p结合Gnai基因3’UTR区调节HSCs细胞活化影响肝纤维化。
乍一看,很多人都觉得:套路,老套路!
恩,小编一开始也是这么觉得的,但是,本文最大的研究亮点在它的fig1,即如何发现并获得了影响肝纤维化的miR-221-3p。
按一般的研究套路,大部分的老师会选择临床样本或动物模型样本进行大规模的测序,筛选差异miRNAs。但本文秀就秀在没有按套路出牌,而是将miRNA文库(302个不同的miRNA的mimics)直接与小鼠肝细胞及肝星型细胞进行共孵育,发现有15个miRNAs直接与肝纤维激活有关。然后再用ELISA检测了上清中TIMP1(可调节肝纤维化)的表达水平,最终发现并确定了miR-221-3p。
文章总结
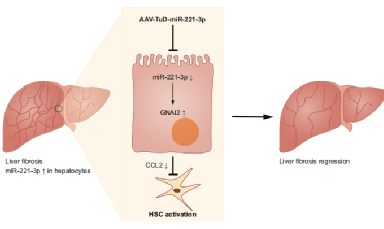
作者通过动物造模、细胞转染、共培养、过表达、干扰载体构建等实验方法,
使用qPCR,原位杂交,WB,HE,天猩红染色,免疫荧光,ELISA等检测技术得到了如下结论。
悄悄告诉大家,这些实验我们都可以做,可随时Call我哦

结论:在慢性肝损伤期间,阻断肝细胞中的miRNA-221-3p功能有助于肝脏的恢复和更快地解决细胞外基质的沉积问题。此外,作者证明,miRNA-221-3p对GNAI2具有转录后调控作用,导致C–C motif趋化因子配体2的分泌减少,从而减轻了肝纤维化。miRNA-221-3p的抑制可作为治疗肝纤维化的治疗方法之一。
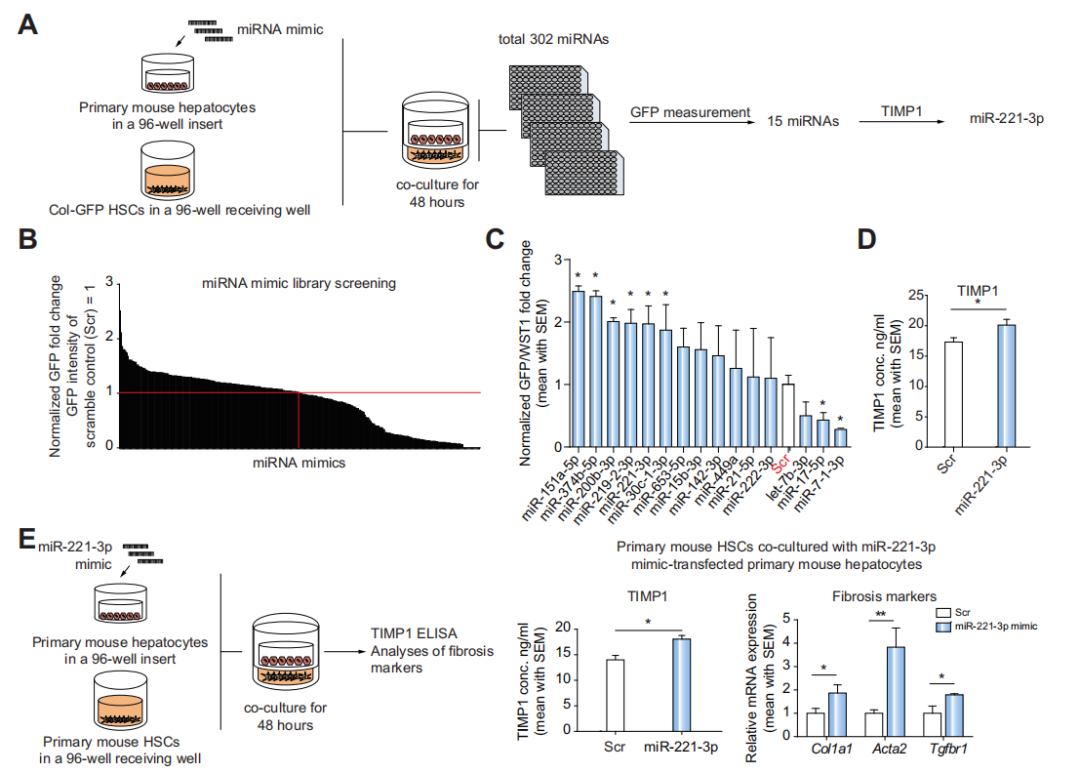
Fig 1 通过miRNA文库筛选得到一个潜在的纤维化调节子:miR-221-3p
作者首先用miRNA文库与小鼠肝细胞进行孵育,然后与Col-GFP HSCs细胞(可简单理解为肝纤维化报告细胞)共培养,得到了15个肝纤维化相关的miRNA,之后ELISA检测TIMP1基因(可以调节纤维化)的表达水平,进而获得了潜在的纤维化调节子:miR-221-3p。(A-E)
注释:Col1a1, Acta2, Tgfbr1均为纤维化的标志物。
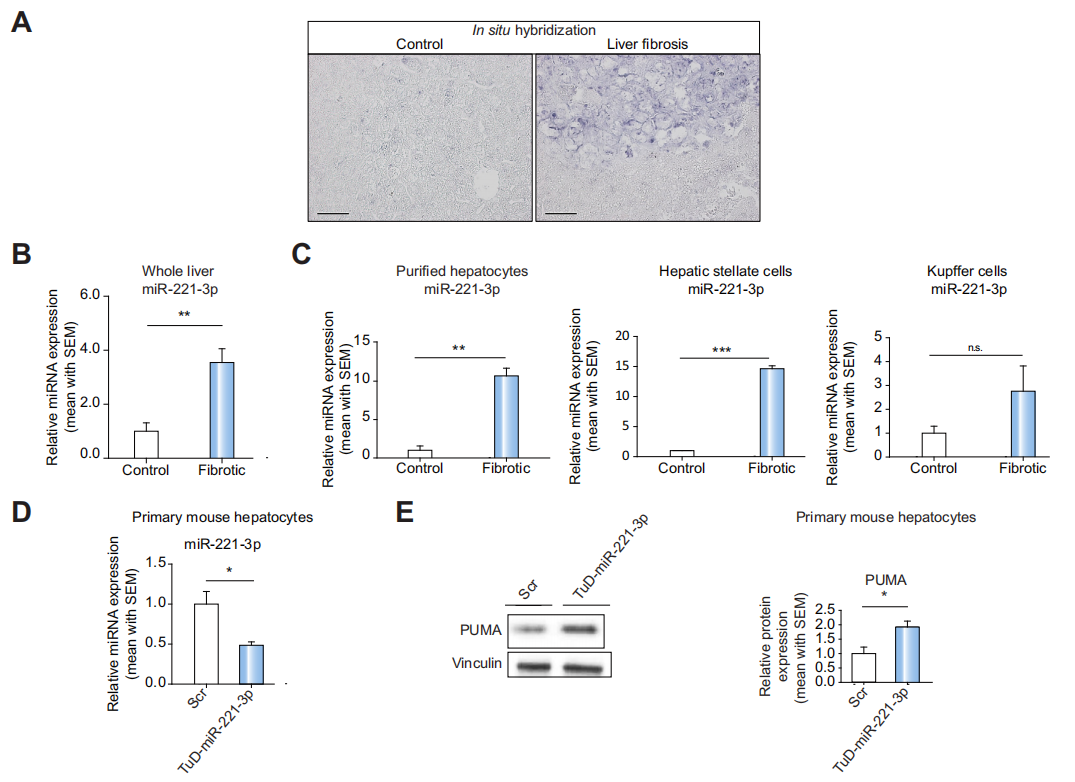
Fig 2 在肝纤维化过程中,原代肝细胞中的miR-221-3p表达上调
原位杂交和qPCR结果显示,肝纤维化小鼠的肝脏miR-221-3表达量显著高于对照组(A,B)。之后分离纯化肝纤维化小鼠的肝细胞、肝星状细胞、Kupffer 细胞,发现在肝细胞、肝星状细胞中,miR-221-3p的表达量显著高于对照组(正常小鼠)(C)。作者之后构建了TuD-miR-221-3p(AAV -Tud) 以后续进行miR-221-3p的敲降。(D,E证明了构建的TuD-miR-221-3p 是有效的)
注释:PUMA (BBC3编码)已知的miR-221-3p靶向蛋白。
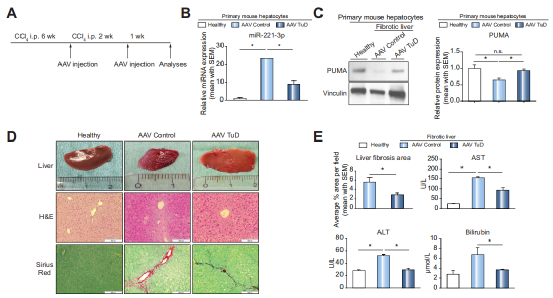
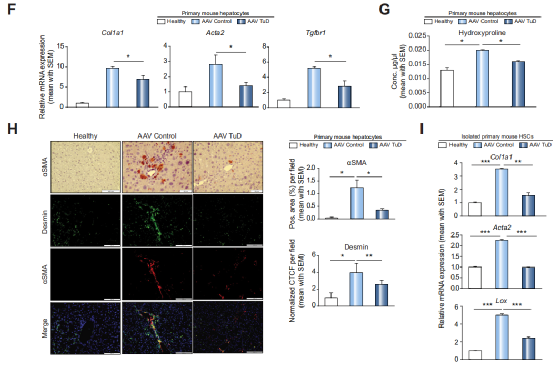
Fig 3 在肝细胞中,miR-221-3p的抑制可减轻肝纤维化
作者进行纤维化小鼠模型构建,并在第6周和第8周注射AAV -Tud,第9周取小鼠组织进行相关实验,qPCR结果显示与Control组相比,AAV -Tud注射组的miR-221-3p 表达量显著降低,WB检测其靶向蛋白PUMA,与Control组相比,PUMA表达量明显上升。由此表明了miR-221-3p功能被抑制(A-C)。之后对组织进行病理染色,与Control组相比,AAV -Tud注射组肝纤维化区域少,且肝损伤以及细胞浸润减少(D,E) ,且血清中的AST、 ALT、bilirubin含量降低(E)。由此表明,miR-221-3p功能抑制可减少肝损伤。
因为纤维化的发展是由HSCs调节的,作者对HSC激活相关的标记蛋白(Col1a1, Acta2, Tgfbr1)进行检测,发现与Control组相比,miR-221-3p的敲降组的肝细胞和肝星状细胞中Col1a1、 Acta2、Tgfbr1表达均下调(F,I)。IF结果显示与Control组相比,miR-221-3p的敲降中a-SMA和结蛋白阳性细胞明显降低(H)。
ɑ-SMA:ɑ平滑肌肌动蛋白, 静止的HSCs通过分化为表达平滑肌肌动蛋白(ɑ-SMA)的成肌纤维细胞而被激活。
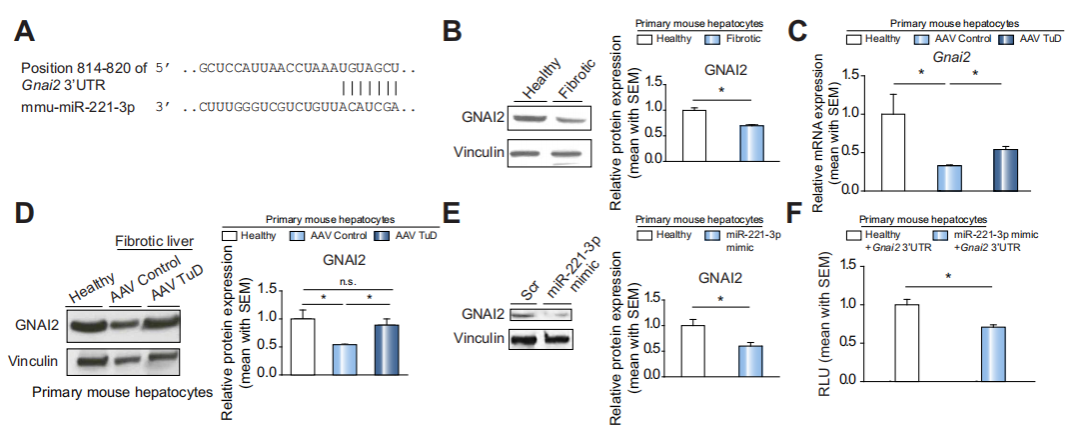
Fig 4 在肝纤维化进程中,miR-221-3p参与Gnai2的转录后调控
作者通过生物信息学分析以及相关软件预测,获得miR-221-3p可能的靶向基因Gnai2(有文章表明其在慢性肝病中扮演重要角色)(A)。WB和qPCR结果显示,与健康组相比GNAI2的表达水平较低(B),与Control相比,AAV Tud组GNAI2表达水平提高(C,D),这可能与miR-221-3p的上调有关。之后用miR-221-3p mimics处理正常肝细胞,结果显示,与阴性对照组相比,miR-221-3p mimics处理组的GNAI2表达水平显著降低(E)。双荧光素酶实验结果进一步证明了miR-221-3p mimics直接靶向Gnai2的3’UTR。综上,作者证明miR-221-3p直接参与Gnai2的转录后调控。
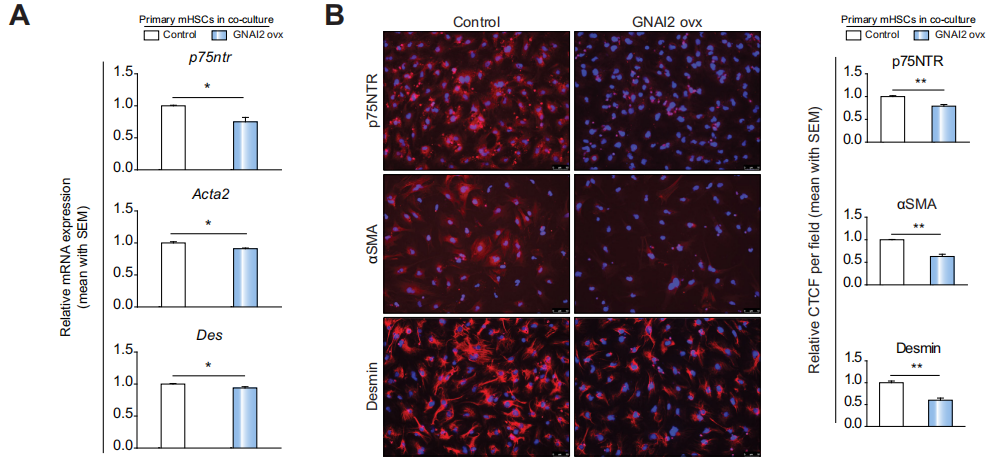
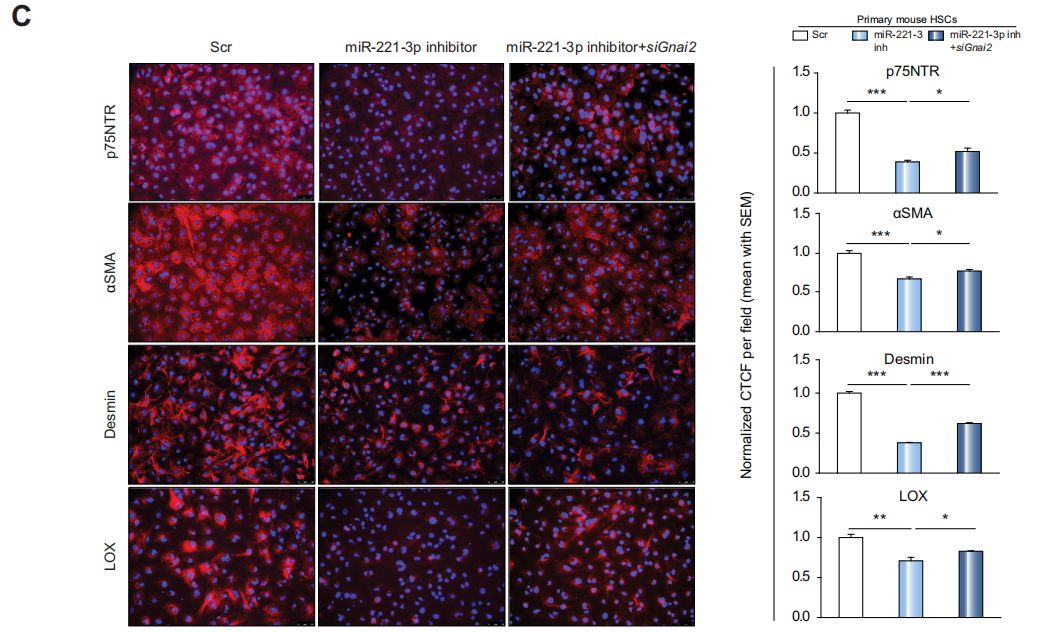
Fig 5 肝细胞中,miR-221-3p的抑制通过GNAI2抑制了HSCs的激活
为了探讨肝细胞中Gnai2的调节是否激活HSCs,作者用Gnai2基因过表达载体处理肝细胞(Gnai2 ovx组),处理一段时间后与HSCs细胞共培养,之后做qPCR和免疫荧光染色,结果显示,与对照组相比,p75NTR、ɑ-SMA、Desmin表达量显著下调。(A,B)
之后作者用miR-221-3p inhibitor以及siGnai2处理肝细胞一段时间后与HSCs细胞共培养,免疫荧光染色结果显示,siGnai2处理抵消了miR-221-3p inhibitor导致的HSCs的激活(C)
。这些结果表明,在肝细胞中,GNAI2有助于减少miR-221-3p抑制时HSC的激活。
备注:p75神经营养素受体(p75NTR)在静止的HSCs中以低水平表达,但在HSCs激活后迅速增加。
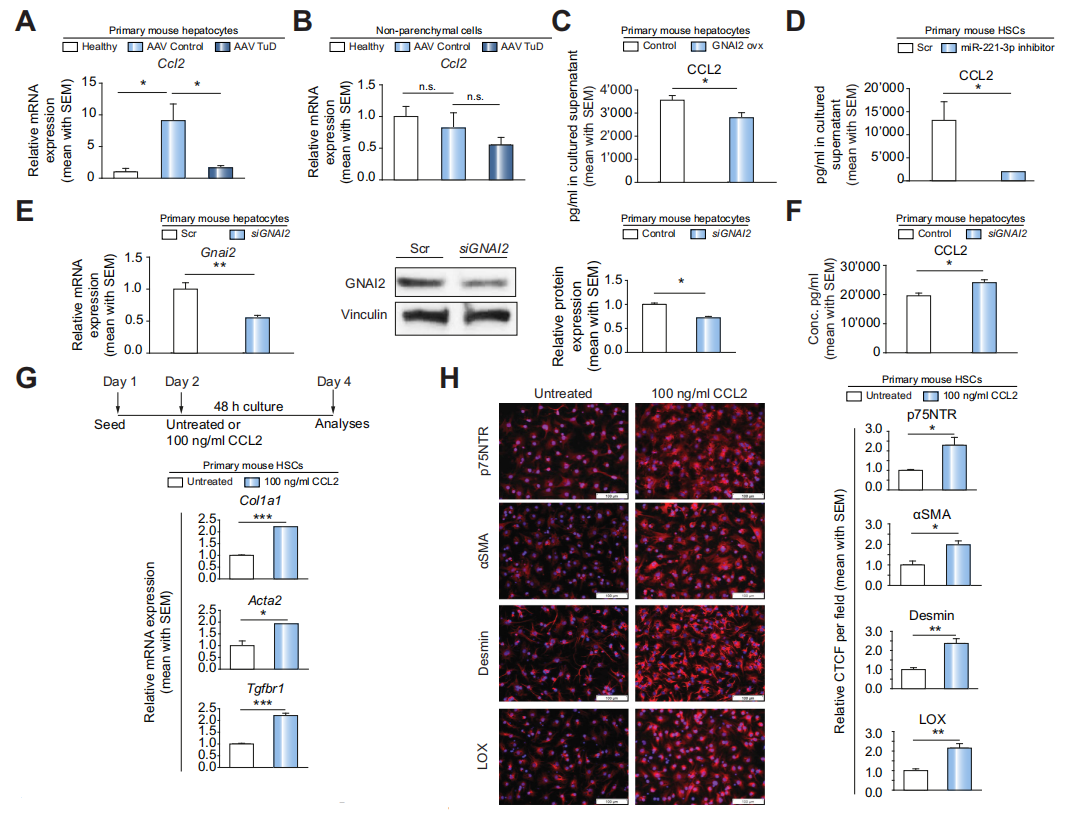
Fig 6 在肝细胞中,GNAI2的上调抑制CCL2表达,进而抑制HSC激活并改善肝纤维化
之后作者想要搞清楚通过GNAI2激活HSCs的机制,作者认为CCL2可能是miR-221-3p/
GNAI2信号的关键部分。作者发现在肝细胞中,与Control组相比,AAVTuD组的CCL2 mRNA显著下调,但在非实质细胞中没有这个现象(A,B)。在肝细胞中,Gnai2过表达可以减少CCL2的分泌(C)。ELISA结果显示miR-221-3p抑制引起CCL2的减少(D)。用siGnai2处理,CCL2的分泌量显著增加(E,F)。
为了进一步验证CCL2对HSCs的直接影响,作者用CCL2处理HSCs,之后用QPCR和免疫荧光染色结果显示, Col1a1、Acta2、Tgfbr1 mRNA水平和p75NTR、a-SMA、desmin蛋白质水平显著增高(G,H)。miR-221-3p inhibitor处理后用同样的方法测相同的指标,结果与CCL2处理组相反(I,J)。
以上结果表明,在肝细胞中,miR-221-3p inhibitor导致GNAI2的上调,而GNAI2的上调进而抑制CCL2表达,从而抑制HSC激活并改善肝纤维化。
备注:趋化因子CCL2,一个关键的调节因子炎症和肝纤维化。已据报道,在小鼠Gnai2基因敲除后升高。
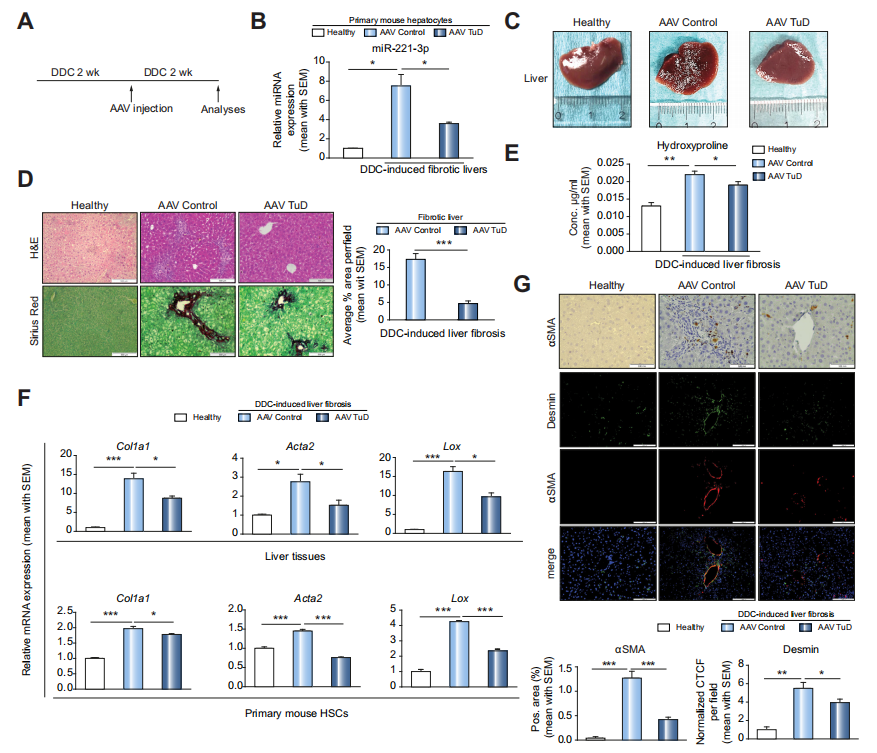
Fig 7 DDC模型中,miR-221-3p抑制同样可减少其肝纤维化
作者为了确定miR-221-3p抑制效果是否仅限于CCl4模型,作者构建胆汁淤积性纤维化(DDC)模型,之后做病理染色以及肝纤维化相关指标的mRNA分析,结果与CCl4模型一致(B-F)。由此可知,miR-221-3p抑制同样可减少DDC模型的肝纤维化。
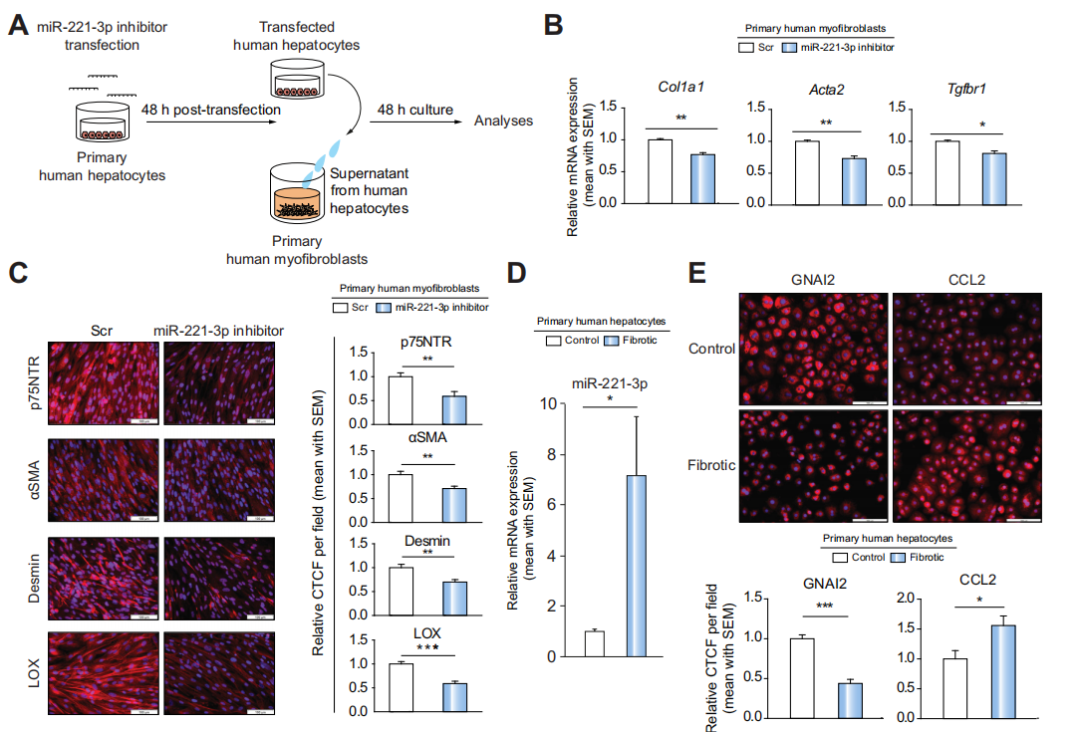
Fig 8 改变miR-221-3p在原代人肝细胞中的表达,抑制原代人肌成纤维细胞纤维化。
为了检测本研究是否适用于人类肝细胞,作者使用miR-221-3p inhibitor处理过的培养基上清处理原发性人类肌成纤维细胞,对Col1a1、Acta2、Tgfbr1进行定量QPCR分析,对p75NTR、a-SMA、desmin、LOX进行免疫荧光染色。结果显示,与Scr组相比,miR-221-3p inhibitor处理组的纤维化相关标记表达水平显著降低(B,C)。这些结果表明,处理miR-221-3p处理组的培养基上清抑制原代人肌成纤维细胞的激活。
最后,作者从纤维化肝脏中分离原代人肝细胞中,检测miR-221-3p的表达是否有改变。qPCR结果显示与对照组相比,miR-221-3p的表达显著提高,GNAI2表达降低,CCL2表达升高(D,E)。
