高分文章都怎么研究m6A甲基化
 2022-01-10 14:50:24
2022-01-10 14:50:24
来源/作者:普拉特泽生物
小编看本文的时候有点艰辛吃力,本着学习的态度,想深入了解作者前期研究。
真是不看不知道,一看吓一跳~~~
这这这这。 。 。 这算是这位大神的低分之作
我我我我,我竟然都有点耍不明白了!

咱也不BB了,一起来拜读一下大神的“低分”之作吧。
先看结论! (如图)
★ERK 通路的激活使 METTL3 和 WTAP 磷酸化。
★METTL3 的磷酸化增加了与 USP5 的相互作用,减少了泛素化,因此稳定m[6]A甲基转移酶复合物促进m[6]A。
★ERK/METTL3/WTAP 信号轴的激活促进干细胞分化和肿瘤发生。
通俗演绎就是:
ERK活化后促进肿瘤发生!
问:为什么会这样呢?
答:因为多能转录本衰变!
问:为什么会衰变呢?
答:因为增加了m[6]A修饰!
问:为什么会增加m[6]A修饰呢?
答:因为甲基转移酶复合物形成了!
问:为什么会形成呢?
答:因为METTL3/WTAP磷酸化了!
问:问什么会磷酸化呢?
答:因为ERK激活了它们!
问:为什么ERK会激活它们呢?
...再问我打人了啊!
要理清楚本文的研究思路,就先要知道(去)磷酸化、(去)泛素化、 m[6]A 这几个关键词。
咱们生物狗子都知道,中心法则是一切基础研究的生命之源。
本文的涉及的:
◆ m[6]A 发生在mRNA转录后,决定mRNA的稳定、翻译或降解。
◆(去)磷酸化发生在蛋白翻译后,决定蛋白质的活化状态。
◆(去)泛素化发生在蛋白翻译后,决定蛋白质的降解或存留。
最终行驶生命活动的单位是蛋白质,但在蛋白质前还有基因组的转录(主要为表观调控)、转录后的修饰(m[6]A、m[5]C等)、可变剪切(外显子跳跃、5端或3端内含子保留等导致的各转录本的形成)、成熟加工(pri-pre-matur的过程调节)、再到RNA翻译为不同的蛋白形式。 但蛋白在不同修饰状态下还会有不同的生物学功能,如磷酸化、甲基化乙酰化、糖基化、泛素化、二聚化、多聚化...
等 ...

我们捋一下本文的Result
Fig1. ERK 激活促进 mRNA m[6]A 甲基化
先看个背景知识补充, 方便理解Fig1
2015年有文献报道含有IRES的circRNAs能够在真核细胞内编码蛋白,接着又发现了不含IRES的阴性对照组circRNAs也能在人类细胞中翻译!此类不含IRES能够翻译的circRNAs有共同的GGACU的序列特征,推断甲基化驱动翻译。

☆1A: 为了鉴定m[6]A RNA甲基化的调节因子,在 HeLa 细胞中使用了包含共有 GGACU 基序 的环状RNA GFP报告基因。 GFP 前体 mRNA转录物通过反向剪接组装以生成连接 GFP 的两个外显子片段的环状 RNA,如图 1A 所示。 m[6] 环状 RNA 上 GGACU 基序的甲基化可以驱动 GFP 转录物的翻译起始,产生 GFP 荧光信号。 因此,来自该环状 RNA 报告基因的GFP信号可用作 m[6]A 甲基化的读数。
☆1B: 针对19,050 个基因和1,864 个 microRNA (miRNA) 进行了基于 CRISPR 敲除的基因组筛选。 将 CRISPR 敲除文库与 circRNA m[6]A-GFP 报告基因相结合,可以筛选 m[6]A 甲基化的可能调节因子。 敲除促进或抑制 m[6]A 甲基化的基因将分别减少或增加 GFP 转录本的翻译。 作者收集了具有 GFP 表达的最多和最低 5% 的细胞,然后进行高通量测序以分别鉴定 m[6]A 甲基化的负调节因子和正调节因子。
☆ 1C: 正如预期的那样,METTL3 的敲除导致屏幕中的 GFP 信号较低。
☆ 1C-D: 低 GFP 表达细胞中 gRNA 的通路富集分析RAS 和 MAPK信号通路的基因 最多。
补充图中发现:m[6]A 甲基转移酶复合物 (METTL3-METTL14-WTAP) 的过表达降低了野生型 RRACT 但不降低突变型 RRTCT 报告基因的表达。为了确定 ERK 如何激活 m[6]A 甲基化,作者首先测试了 ERK 是否与 mRNA m[6]A 甲基转移酶复合物相互作用。免疫共沉淀表明,在 BRAF 转染后,METTL3 与 ERK1 和 ERK2 结合(图 S2A)。
Fig2. ERK 磷酸化 METTL3 和 WTAP
Trametinib : MEK抑制剂,是一种高特异性的,有效的MEK1/2抑制剂,可激活自噬并诱导凋亡。
A375 细胞 : 是一种由于 BRAF V600E 突变而具有组成型活性 ERK 的人类黑色素瘤细胞系。
☆ 2A : 在 A375 细胞中观察到内源性 ERK2 与 METTL3 和 WTAP 的相互作用,A375 细胞是一种由于 BRAF V600E 突变而具有组成型活性 ERK 的人类黑色素瘤细胞系(图 2A)。
☆ 2B : ERK 使用一个共同的 对接域 (CD)与 D 域结合(K/R0–2-X1–6-φ-X- φ) 或绑定到 F 域 (FX-F/YP)。 使用真核线性基序数据库 (http://elm.eu.org) 的分析显示 METTL3 中的残基 415-421 和 WTAP 中的残基 71-77 是潜在的保守 D 域。
☆ 2C: ERK2 的 CD 突变体(321N) 解除了 METTL3 和 WTAP 的相互作用,而 FRS 突变体(263A) 没有。 免疫共沉淀 (co -IP) 显示 ERK2 仅与 D 域所在的 myc 标记域结 合(图 S2D)。 这些结果支持 ERK 与 METTL3 和 WTAP 的交互。
☆ (图 S2F)进一步验证了 METTL3 是否是 ERK 的底物。 体外激酶测定表明 ERK 直接磷酸化 METTL3。
☆ 2D-F: 质谱分析表明 ERK 磷酸化METTL3 在三个高度保守的残基: S43、S50 和 S525。 突变分析进一步证实这三个位点是主要的 ERK 磷酸化位点(图 2F)。 【图中 3A 组: 指 METTL3所有三个磷酸化丝氨酸位点都被丙氨酸取代 】
☆ 2G-H : 为了确定 WTAP 的磷酸化位点,检测了 S/TP 基序的突变是否影响 ERK 诱导的磷酸化。 在人类 WTAP 的三个 S/TP 基序中,我们发现 S306 和 S341 是人类 WTAP 的主要 ERK 磷酸化位点。
接下来作者探讨了 ERK 诱导的磷酸化如何增加 RNA m[6]A 甲基转移酶复合物的活性。
Fig3. ERK 介导的 METTL3 稳定需要 USP5
在分子生物学中放线菌酮可被用来确定蛋白质(酶)的半衰期。 使用放线菌酮处理细胞,然后使用western blot实验来显示要被研究的蛋白质随时间的数量变化。 由于放线菌酮阻碍蛋白质的合成,细胞内的蛋白质不断减少。
☆ 3A : METTL3 在 mESC 和人 A375 细胞中WT组始终比 3A 组更高的表达水平, WTAP也是WT组比2A组始终表达高 。 这一观察结果提出了一个假设,其中 ERK 使 METTL3 磷酸化稳定了蛋白质,这可以解释更 好的ERK 激活观察到 METTL3 蛋白水平和 m[6]A 甲基化活性升高。
☆ 在补充图里研究了 ERK 激活是否会影响 METTL3 稳定性,用ERK抑制剂 PD0325901 处理8h,增加了蛋白的泛素化(图 S3A)。
☆ 3B : 3A 组的 METTL3的 泛素化水平也高于 WT 组。
☆ 3C: 为了更直接地评估 ERK 对 METTL3 稳定性的影响,使用放线菌酮抑制蛋白质合成,并监测 METTL3 蛋白质降解情况。 如图 3C 所示, ERK 激活增加了 WT 的稳定性,但没有增加不可磷酸化的 3A METTL3 ; 与 WT METTL3 相比,磷酸化模拟物 3E METTL3 显示出稳定性的增加。
为了进一步了解 ERK 磷酸化如何降低 METTL3 泛素化,补充图中发现 USP5 和 USP1的敲低降低了 A375 细胞中的 METTL3(图 S4B)。市售的 USP1 抑制剂 SJB3-019A 和 USP5 抑制剂 EOAI3402143 (EOAI) 也降低了 METTL3(图 S4C)。考虑到 USP5 涉及广泛的病理过程,并且对 METTL3 的影响最显着,选择进一步研究它。
☆ 3D : 随后研究了在活化的 BRAF 存在下 METTL3 的磷酸化是否会影响 METTL3-USP5 相互作用。 作者注意到 ERK 激活增加了 METTL3 和 USP5 之间的相互作用,这种相互作用随着磷酸缺陷突变体 S43A、S50A、S525A 变弱,并在所有三个位点都发生突变时完全减弱。 3E METTL3 与 USP5 的结合更强。 BRAF 表达也进一步促进了 3E METTL3-USP5 相互作用并增加了其表达。 这表明 BRAF 也可能影响 USP5 活性。
因为 USP5 是一种可以阻止蛋白质泛素化的酶,进一步验证了 USP5 是否通过去泛素化稳定 METTL3。
☆ 3E : WT 组(过表达 USP5 )比 C335A 组(过表达突变的 USP5 )降低了泛素化并稳定了 METTL3。
☆ 3F: 找到 抑制 USP5 而诱导 METTL3 的降解的泛素连接酶, 作者搜索了共识基序和物理关联数据库以及基于 CRISPR 的基因组筛选。 METTL3 包含 SPOP 结合共识基序和 COP1 结合破坏基序 (http://elm.eu.org)。 它还与 TRIM28、HUWE1 和 UBR5 (https://thebiogrid.org) 相互作用,并且可能被 SMURF1 (
http://ubibrowser.ncpsb.org) 泛素化。从 CRISPR 筛选中鉴定出 FBXW8、FBXW12、SPOPL、TRIM2 和 ANAPC1 作为 m[6]A 甲基化的负调节因子。 为了找到参与 METTL3 降解的泛素连接酶,用靶向泛素连接酶的小干扰 RNA (siRNA) 进一步转染 USP5 敲低的 A375 细胞。 敲除 SPOP、TRIM28 或 ANAPC1 部分消除了 USP5 抑制介导的 METTL3 降解。
总之,这些结果表明 USP5 通过去泛素化稳定 METTL3
Fig4. ERK 对 METTL3/WTAP 的磷酸化促进 细胞分化
mESC: 小鼠胚胎干细胞
据报道,自分泌 FGF4 是 mESC 中 ERK 信号传导的主要刺激物。FGFR 或 ERK 活性的干扰阻碍了 mESCs 进行分化和保留多能性因子(包括 Nanog)表达的能力。
作者观察到 p-43 METTL3 磷酸化被 FGF4 增强并被 MEK 抑制剂 PD0325901 或 FGFR1 抑制剂 PD173074 降低(图 S5A)。 因为据报道, mESCs 在分化时退出多能状态需要 ERK 激活和 METTL3 表达, 因此作者进一步研究了 METTL3/WTAP 的磷酸化是否影响 mESC 命运 。
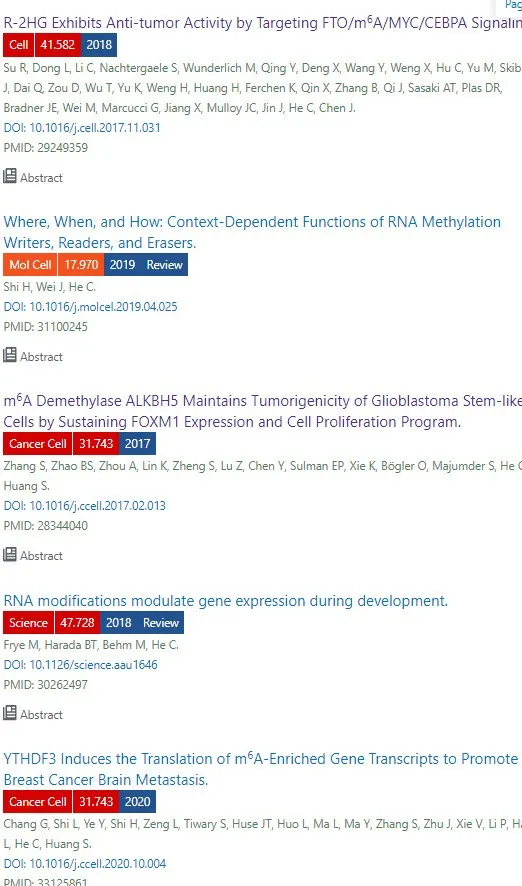
☆ 4A : 将 TetOn-shWTAP 引入 METTL3 敲除 (KO) 的 mESC 以调整内源性 WTAP 表达。 然后用 WT 或磷酸失活突变体 CuO-METTL3-T2A-WTAP 转 染细胞。 通过液相色谱-串联质谱( LC-MS/MS ) 对 m[6]A 的定量显示出 3A METTL3 和 2A WTAP 的协同减少。
☆ 4B : R-3A2A mESCs 表现出更高的增殖增加和阶段特异性胚胎抗原 1 (SSEA-1) 表达(图 S5C)。 这些观察结果支持 METTL3 和 WTAP 磷酸化的丧失将 mESC 维持在多能状态的观点。
☆ 4C : m[6]A 甲基化多能性因子转录本,包括 Nanog、Zfp42、Klf2、Sox2 和 Lefty1。 不含任何 m[6]A 修饰的 Pou5f1 也用作阴性对照。 m[6]A-RIP-qPCR 证实 m[6]A 减少,qRT-PCR 表明这些 m[6]A 标记的多能性转录本在 R-3A2A mESC 中上调(图 4D)。
☆ 4E : R-3A2A mESCs 未能抑制多能基因,并充分上调发育标记 物的指标。
这些结果支持 METTL3 和 WTAP 的 ERK 依赖性磷酸化促进 mESC 分化的观点。
Fig5-6. 受 mESC 中甲基转移酶复合物磷酸化影响的转录本
为了进一步了解 m[6]A 甲基转移酶复合物的磷酸化如何影响 m[6]A 修饰的转录本,作者绘制了 mESC 中的 m[6]A 甲基化组。
☆5A : R-WT 与 R-3A2A mESC 的比较揭示了甲基化位点的整体丢失。
☆ 5B-C: 使用作者内部 R 包“MeRIPtools”: 它使用基于二项分布的模型测试 m[6]A IP 富集; 发现 7,591 m[6]A 峰显示 R-3A2A 细胞显着减少与 R-WT 细胞相比,例如 Nanog、Lefty1 和 Zfp219 中的修饰位点(图 5C)。
☆ 5D-F: GO分析, m[6]A 甲基化降低(图 5D)和差异表达(图 5E)的转录本富集了与多能性和 mRNA 加工相关的基因。 重要的是,与 R-WT mESCs 相比, 许多参与多能性的基因在 R-3A2A 细胞中显示出降低的 m[6]A 甲基化 (图 5F)。
☆ 6A-B : 正如预期的那样,m[6]A 甲基转移酶复合物在 R-3A2A A375 细胞中的稳定性降低,这导致 mRNA 的整体 m[6]A 水平较低(图6B)。
☆ 6C-D: 发现 MEK 抑制剂 PD0325901 和Trametinib 可减少蛋白质A375 黑色素瘤细胞中 m[6]A 甲基转移酶复合物的水平 (图 6C) 和整体 mRNA m[6]A 水平 (图 6D)。
☆ 6E : 使用两种结构无关的 USP5 抑制剂 EOAI 和 vialinin 来评估 USP5 对黑色素瘤中 METTL3 水平的影响细胞。 发现这两种 USP5 抑制剂增加了 METTL3 的泛素化,导致 METTL3 蛋白水平降低 (图 6E、S7E 和 S7F)。
☆ 6F : MEK 抑制 剂, R-3A2A 或 METTL3-WTAP 敲低可使黑色素瘤和结肠癌细胞对 USP5 抑制敏感(图 6F 和 S7G),支持 USP5 和 METTL3 之间的联系。
最后,考虑到 HER2 表达使 METTL3 和 WTAP 磷酸化(图 S1C 和 S7H),并且过表达 HER2 的 SKBR3 和 BT474 细胞中的 m[6]A 水平更高(图 S7I),研究了抑制 HER2 是否会影响 m[6] ]甲基化。
☆ 6G-H: 两种 HER2 抑制剂,tucatinib 和 lapatinib,可以降低 HER2 阳性乳腺癌中 METTL3 蛋白水平和 mRNA m[6]A 甲基化(图 6G 和 6H)。
总体而言,这些数据 支持 ERK 依赖性 METTL3 稳定性影响细胞 mRNA m[6]A 甲基化,这可能有助于肿瘤发生。
好了文章就到这里了,