

让你的lncRNA摆脱miRNA的束缚(完结篇)
 2021-10-18 10:19:17
2021-10-18 10:19:17
来源/作者:普拉特泽生物-医学整体课题外包
转眼又到愉快周末。在前两篇中,小编为大家介绍了组蛋白甲基化,RBP,lncRNA三种lncRNA机制研究的新切入点,老样子,忘得差不多的同学可以点击前两篇文章进行复习。
复习中透露着疲惫
这期我们将迎来本系列的完结篇,探寻lncRNA对蛋白稳定性的调控,从前面两期的转录前,转录后水平的调控,到本期的翻译后水平的调控。
LncRNA与蛋白稳定性(protein stability)
本节关键词:蛋白稳定性,泛素化本节文献:Long noncoding RNA AGPG regulates PFKFB3-mediated tumor glycolytic reprogramming,nature communication
回顾前面3种lncRNA发挥功能的方式,我们可以发现lncRNA主要扮演一个间接促进者的作用,通过与功能蛋白结合,增强功能蛋白对下游靶蛋白的调控。而最后,我们来看看lncRNA是如何直接调控靶蛋白的表达。
这篇范文2020发表于大家所熟知的nature communication,虽然该杂志一直有些争议,但是我们还是可以默默地感受一下贫富差距。作者首先说明了在之前的研究中通过RNA pull down联用质谱的方式确认了lncRNA AGPG与靶蛋白PFKFB3的结合(没错,就是在lncRNA与RBP中提到的方法),然后在本文中通过RNA pull down(Fig3a,Fig3b)以及RIP(Fig3c)做了进一步的验证。
值得注意的是,在Fig3b中作者还加入了包含His标签的重组型外源PFKFB3的验证。进一步地,作者使用了在之前几篇文章中都没有出现过的MTRAP/WB联用(Fig3d)以及FISH/免疫荧光激光共聚焦共定位(Fig3e)的方法,再次验证了AGPG与PFKFB3的结合。
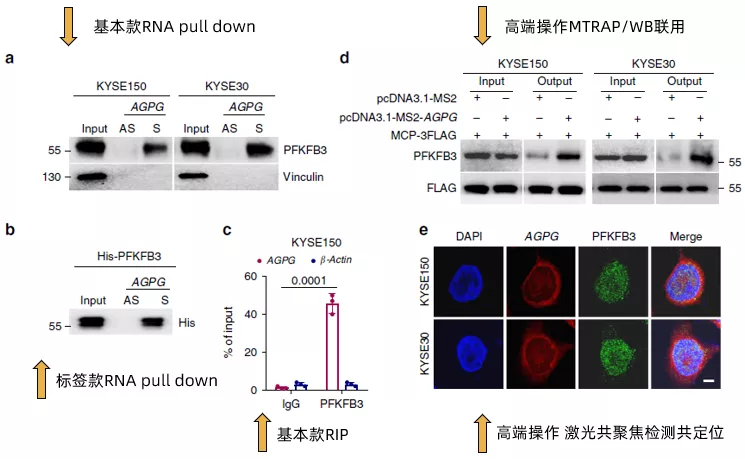

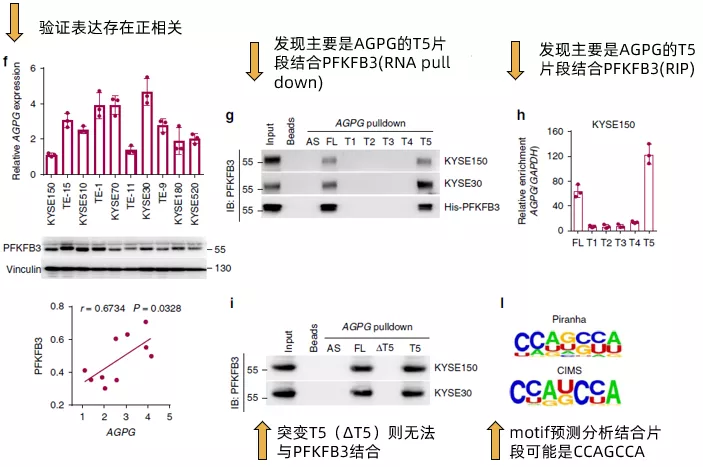
接下来,作者在多种食管鳞状细胞癌细胞系以及临床组织样本中确认了AGPG与PFKFB3的表达呈现正相关(Fig3f),且其在补充材料的数据甚至做到了拷贝数和分子数的绝对值的对应关系(~ 400–700 AGPG molecules per cell versus ~4400–7400 PFKFB3 molecules per cell)。通过计算机分析AGPG的二级结构,发现其有5个主要的branches(还是放在了补充材料里),通过合成全长以及这五个branches片段(T1~T5)的AGPG,作者发现T5片段是主要结合PFKFB3的区域(Fig 3g,Fig 3h)。而突变T5(ΔT5)则无法与PFKFB3结合。最后,通过motif预测分析,发现结合PFKFB3的片段可能是CCAGCCA(Fig 3I)。简单来看,fig3的所有这些结果,其实就是说明了AGPG与PFKFB3的结合并影响了PFKFB3的表达,但是在设计上充分展示了丰度(经费)。
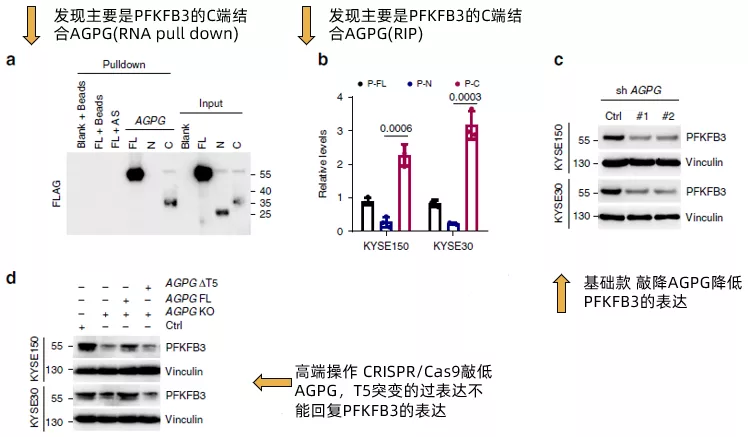
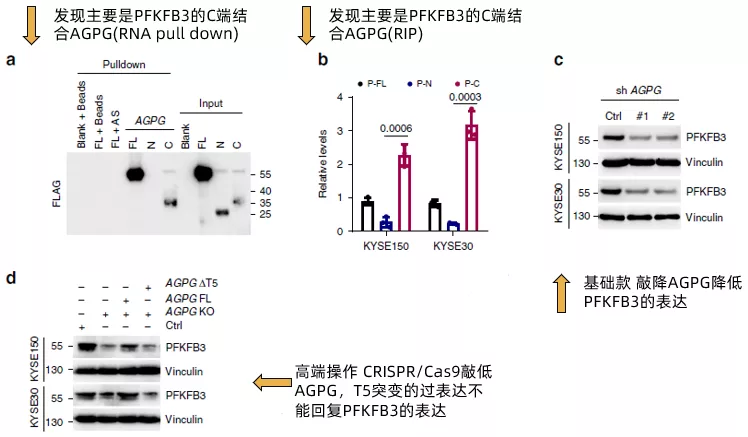
在确认了AGPG的T5片段能够与PFKFB3结合后,作者进一步将PFKFB3拆分为全长,N端和C端,通过RNA pull down(fig4a)和RIP(fig4b)证实了PFKFB3通过C端与AGPG结合。然后,作者评估了AGPG对PFKFB3的表达的影响。AGPG沉默明显降低PGKFB3的表达(fig4c),使用CRISPR / Cas9的CRISPR KO细胞得到了类似的结果(fig4d)。而AGPG的T5突变(ΔT5) 未能回复PFKFB3的表达。

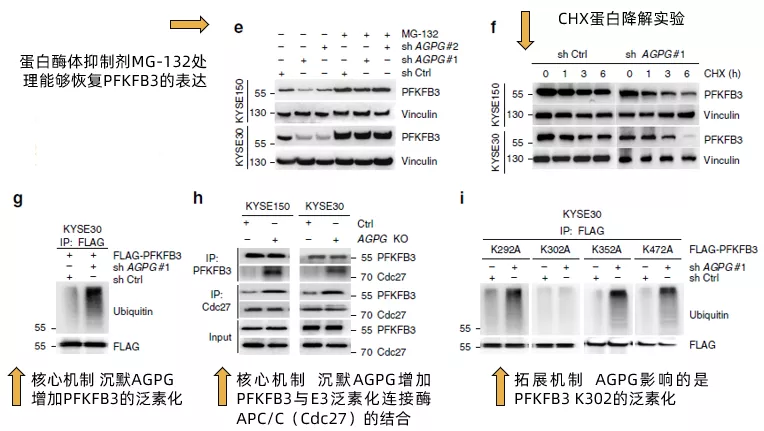
接下来到了关键的部分,作者援引文献说明PFKFB3经常经由泛素化(polyubiquitination)修饰的方式受到蛋白酶体(proteosomal degradation)的降解。在这里我们插播一段关于泛素化和蛋白降解的基本原理的描述:
E1泛素激活酶(ubiquitin-activating enzyme), E2泛素偶联酶(ubiquitin-conjugating enzymes), E3泛素连接酶(E3 ubiquitin ligase)通过给蛋白的赖氨酸残基(K)加上泛素化标签(ubiquitin),导致被修饰的蛋白将进入蛋白酶体中被降解。这是细胞降解蛋白的主要方式。其中,研究最广的是E3 ligase。
回到文中,作者发现蛋白酶体抑制剂MG-132能够恢复PFKFB3的表达(fig4e),暗示APGP沉默引起的PFKFB3的降低与蛋白酶体降解有关;且通过CHX蛋白降解实验验证了沉默AGPG会加速PFKFB3的降解(Fig 4f)。接下来,通过检测蛋白的泛素化,作者发现沉默AGPG会大幅增加PFKFB3蛋白的泛素化水平(Fig 4g),增加PFKFB3与E3泛素连接酶APC/C的结合(Fig 4h),至于图中为什么用的是Cdc27,作者也给出了解释“active APC/C could be immunoprecipitated from cells using a monoclonal Cdc27 antibody”。
最后,作者进一步确认了AGPG通过影响PFKFB3 C端的某一个赖氨酸残基来避免其受到泛素化修饰。通过将C端四个赖氨酸(K)残基分别突变成丙氨酸(A),作者发现只有第302位的K突变后(K302A),PFKFB3不再被AGPG沉默升高,证实AGPG影响的是PFKFB3 K302的泛素化(Fig 4i)。至此,作者完成了AGPG通过结合PFKFB3,减少PFKFB3的泛素化,从而升高PFKFB3的稳定性的论证。

由于本文对机制的研究较深,我们尽量在去除一些高端超纲操作的情况下,总结一个亲民版的套路:
通过质谱或者预测,找到一个能够与lncRNA结合的蛋白,这个蛋白最好有报道被泛素化降解。通过RIP和RNA pull down验证其结合,通过WB,蛋白降解实验,验证lncRNA能够提高蛋白的稳定性,通过检测泛素化水平,以及CO-IP实验,验证lncRNA能够通过减少靶蛋白与E3泛素化连接酶的结合,从而减少靶蛋白的泛素化。
小拓展:在本篇范文的后续结果中,作者还找到了调控AGPG的上游转录因子P53,有兴趣的同学可以结合上一篇内容以及本文的思路假设图自行研究 (用黄线圈出来的部分即是关于lncRNA的机制部分)

好了,到此,经过三篇推送,我们基本了解了lncRNA在摆脱miRNA之后的四种主要研究方向:组蛋白甲基化,RBP, 转录因子,蛋白稳定性。聪明的同学肯定早已发现,其本质就是探究lncRNA通过与蛋白结合,直接地或间接地影响蛋白的功能的机制。发散来看,细胞中调控蛋白功能/表达的方式远不止这四种,那么lncRNA能够走的套路也是千千万万(是不是有点跃跃欲试),一些文章探索lncRNA通过相对独特的方式调控蛋白的功能,有时也让人眼前一亮。但是,还是要敲一下黑板,作为基层科研工作者,切忌好高骛远,既不要觉得lncRNA继续绑着miRNA来做就很低端,也不要盲目地觉得直接上lncRNA与蛋白就一定能发高分。最后我们对本系列的内容再做个技术总结吧,预祝大家手头的lncRNA都能发光发热。

-END-
