

很多人WB结果不好,却没怀疑过自己的胶选错了
 2025-10-28 11:55:23
2025-10-28 11:55:23
来源/作者:普拉特泽-生物医学整体课题外包平台
Question:很多人WB结果不好,却没怀疑过自己的胶选错了(普拉特泽生物提供长期稳定的wb实验外包服务)
把聚丙烯酰胺凝胶想象成一个分子筛网:
1)高浓度胶(如15%):网眼小,小蛋白能灵活穿梭,大蛋白则寸步难行
2)低浓度胶(如8%):网眼大,大蛋白可以自由奔驰,小蛋白却可能“刹不住车”
选错浓度会怎样?
1)胶太浓:大蛋白分离不开,挤成一团
2)胶太稀:小蛋白跑得太快,直接“跑丢”
二、到底应该怎么选择浓度胶呢❓
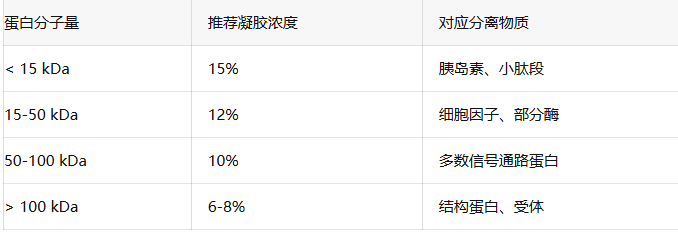
2)大蛋白用低浓度:更容易分离且转膜更充分
3)梯度胶是神器:从上到下浓度递增,一块胶搞定不同大小蛋白
1)应对超大或超小分子量蛋白
对于大于200 kDa的蛋白,比如200 kDa或280 kDa的蛋白,推荐使用6%或7% 的分离胶,并适当延长电泳时间。
对于小于20 kDa的小分子蛋白或多肽,常规的Tris-甘氨酸系统分离效果可能不佳。这时,Tris-Tricine缓冲系统的预制胶(例如16.5% 的浓度)是更好的选择,它能更有效地分离2-40 kDa的小分子量蛋白。
2)使用梯度胶应对宽范围或不同大小的蛋白
如果需要分离的蛋白分子量分布很广,或者想在同一块胶上同时分析多个不同大小的蛋白,梯度胶(例如4-12% , 4-20% )会非常方便。它从胶顶到胶底的浓度是连续变化的,因此可以在同一块胶上清晰地分离出分子量差异很大的蛋白。
三、经验

⭐⭐ 这是快要结束的时候

、
1.根据自己的目标分子选择对应的浓度胶,保证蛋白电泳过程中顺利下沉及分开,不懂时可以咨询一下师兄师姐,特别是与他人蛋白kd数差距甚远时。
2.配胶时一定要注意添加手法,学姐一直推荐左右滑动着加上下层胶,因为在玻璃板的一角加入,容易导致配胶浓度不均,即使添加前已吹打混匀,添加完毕+插完梳子以后,将制胶架于实验桌上轻磕一下,保证分界线平齐。
3.配胶后凝固时间适当,学姐真的不建议提前配胶,尽量现配现用,学姐之前在北方,夏天冬天温差不是特别大(因为北方有暖气),所以我夏天和冬天的凝胶时间都是固定的。但是学姐现在到南方了,冬天的时候气温低,凝胶时间就需要延长20-30min,或者多添加一些促凝剂,以便缩短凝胶时间。
判断浓度胶凝固知识点:插梳子以后,玻璃板会多出一部分上层胶流在制胶架上,我们可以等待20-30min以后,将玻璃板拆卸下来,看看多余的胶是否凝好,若是呈胶条状,则代表胶已凝好,可以电泳。
4.注意缓冲液系统,分离小分子量蛋白(<20 kDa)时,记得Tris-Tricine系统比常规的Tris-甘氨酸系统效果更好。
5.预制胶是很多同学的优先选择,因为可以节省配胶时间,但是一定要注意预制胶的保存以及使用方法,否则可能会让你浪费更多的时间去试错。对于大分子量蛋白,有建议使用6%的分离胶,而小分子量蛋白则可选用16.5%的Tricine预制胶,常规分子量推荐10%的预制胶。
文源【医学盛夏学姐】
普拉特泽,坚持提供真实、完整、唯一原始数据、原始图片。
普拉特泽生物,自有专业动物房、造模实验室,配套设备齐全,技术团队成熟,熟练掌握各类动物模型构建,更有细胞、分子、病理平台,一站式解决后续相关实验检测。请点击分子实验平台了解详情
大家一起学习吧!!18570028002(微信同号)
