

让你的lncRNA摆脱miRNA的束缚(上)
 2021-09-29 13:42:18
2021-09-29 13:42:18
来源/作者:普拉特泽生物-医学整体课题外包
非编码RNA近几年来的热度虽然有所降低,但瘦死的骆驼依然能发文章。如果没有一个新颖的靶蛋白砸到脑袋上,非编码RNA的万精油套路仍然还是广大基层科研工作者冲击高分的首选。对于非编码RNA家族的成员,各位同学最熟悉的当然是lncRNA和miRNA两兄弟了。这两兄弟通过一种叫做ceRNA(competitive endogenous RNA)的听着挺高端,其实挺简单的机制,硬是在过去的十来年往江湖里灌了不少的农夫山泉。

然鹅,好景不长,miRNA这不争气的娃娃近几年率先显了疲态,单独研究miRNA的文章分值区间一再走低,miRNA渐渐地就变成了一个傍着lncRNA这个老大哥出现的小老弟。虽然以lncRNA/miRNA/靶基因为主轴的套路依然适用于3-5分的区间,甚至在你的lncRNA足够新颖的情况下依然有能力冲击更高的分数,但是有梦想的lncRNA也开始逐渐往新的方向拓展。
那么这次就由野菜君通过几篇典型文献来给各位同学介绍4种有别于ceRNA机制的lncRNA的研究方向,如果你手头正好有一个热乎的lncRNA,又不再想走miRNA的水路,或许能从里面找到一些灵感。
(一)
LncRNA与组蛋白甲基化(histone methylation)
本节关键词:PRC2复合物,EZH2,H3K27三甲基化修饰
本节相关文献:Long noncoding RNA AFAP1-AS1 predicts a poor prognosis and regulates non–small cell lung cancer cell proliferation by epigenetically repressing p21 expression,Molecular Cancer ,IF:10.6
首先我们来看一种lncRNA在告别miRNA后最常见的路子——组蛋白甲基化。组蛋白甲基化是调控基因表达的重要方式,主要包括H3K27me3,H3K9me3,H3K4me3等等。我们以H3K27me3这种与lncRNA的相关报道最多的修饰方式为例,其含义是组蛋白Histone 3 (H3) 的第27位的赖氨酸 (K) 被三甲基化(me3)修饰,而带有这种修饰的组蛋白结合到靶基因的启动子区域,就会抑制靶基因的表达。细胞内主要负责H3K27me3修饰的是PRC2(Polycomb Repressive Complex 2)这个复合物。然后呢,这个复合物主要由EZH2, SUZ12, EED等几个亚基组成,其中EZH2(Enhancer Of Zeste 2)又是直接具有甲基化转移酶催化活性的最重要的亚基。近年来,发现PRC2以及EZH2在肿瘤中上调,通过抑制多种抑癌基因的表达,发挥促癌作用。为了方便阅读,我们可以通过一张模式图对这个机制先有一个大概的印象。

好了,介绍完背景,我们通过一篇典型文献来看看针对我们的lncRNA,如何研究它调节组蛋白甲基化的机制。这篇文献18年发表在molecular cancer上(Long noncoding RNA AFAP1-AS1 predicts a poor prognosis and regulates non–small cell lung cancer cell proliferation by epigenetically repressing p21 expression)。值得一提地是,这个杂志影响因子近几年的影响因子在5-7的区间徘徊,但是2018年神奇地蹿升到了10.6分。关于lncRNA对肿瘤基础表型的功能验证就不在此赘述了,我们直接看机制部分结果。
首先,作者通过测序和GO分析,发现在A549细胞中敲除AFAP1-AS1能够引起300多个基因上调两倍以上(Fig. 4a)以及这些基因与细胞增殖(Fig. 4b)等过程有关。当然,这一步也不是必须的,我们完全可以通过公共数据库的挖掘(比如TCGA)找出在某肿瘤中与AFAP1-AS1的表达呈负相关的抑癌基因,或直接像(Fig. 4c)和(Fig. 4d)的结果那样,选取一些经典的抑癌因子进行qPCR的验证,同时这些抑癌因子又往往是有报道被EZH2抑制的。总之,这一步就是找出调控AFAP1-AS1引起的差异表达基因。
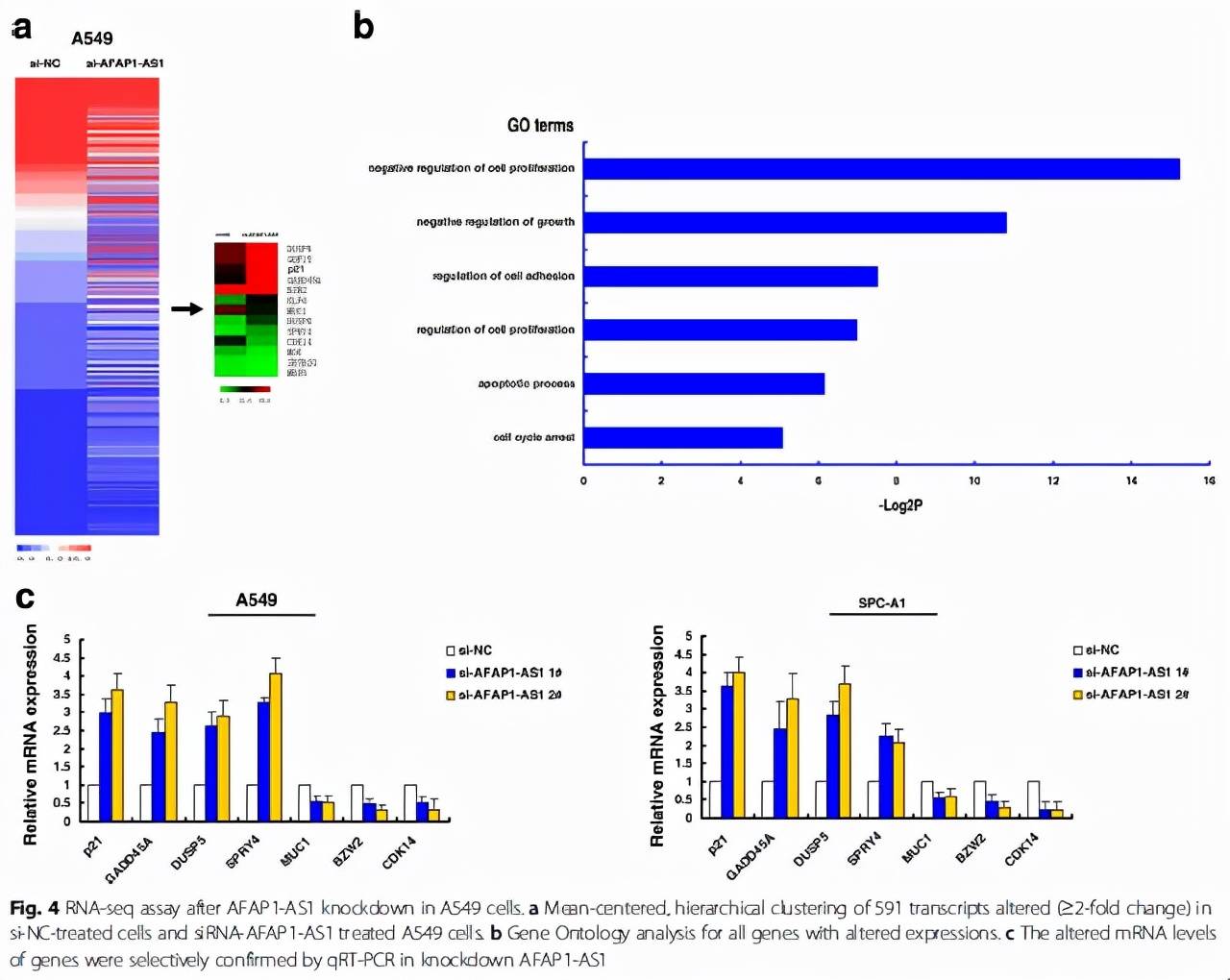
然后呢,作者先是验证了AFAP1-AS1在核内和胞浆的表达分布,毕竟我们的H3K27me3修饰是发生在核内(Fig. 5a),再通过RIP的方式验证了AFAP1-AS1与EZH2以及SUZ12均有结合(Fig. 5b)。
小拓展:对于具体lncRNA与EZH2结合后是通过何种方式发挥作用,这个机制大多数研究都是没有再深究的。就连发表在PNAS上的lncRNA/EZH2套路文章也仅仅是探明了lncRNA上的一段富G的片段(G-rich motif)参与结合了EZH2,而关于EZH2上结合lncRNA的片段,可能存在于其N端的32–42 helix。有兴趣的读者可以自行参看这两篇补充文献深入了解(HERES, a lncRNA that regulates canonical and noncanonical Wnt signaling pathways via interaction with EZH2;Conserved RNA-binding specificity of polycomb repressive complex 2 is achieved by dispersed amino acid patches in EZH2) 。

最后,作者把下游的靶基因锁定在p21这个经典的抑癌基因,进一步验证了AFAP1-AS1和EZH2分别对p21表达的调控(Fig. 6a,Fig. 6b),同时,通过CHIP实验,发现敲除AFAP1-AS1后,EZH2以及H3K27me3在p21启动子区域的结合降低,最终导致p21的表达抑制被解除(Fig. 6c)。
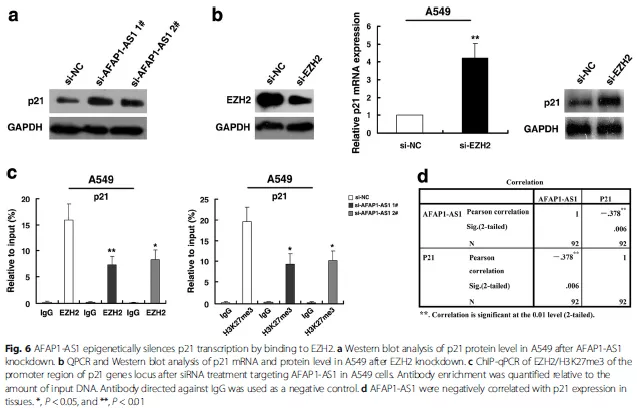
至此,作者用最低碳的方式,验证了核内的AFAP1-AS1通过结合EZH2(RIP,RNA pull down实验),将EZH2募集(recruitment)到靶基因p21的启动子区域(CHIP实验),EZH2通过将该区域的H3组蛋白进行H3K27me3修饰,抑制p21的表达(WB, qPCR验证)。将之前的那个作用模式图用具体的分子代替就是这样:
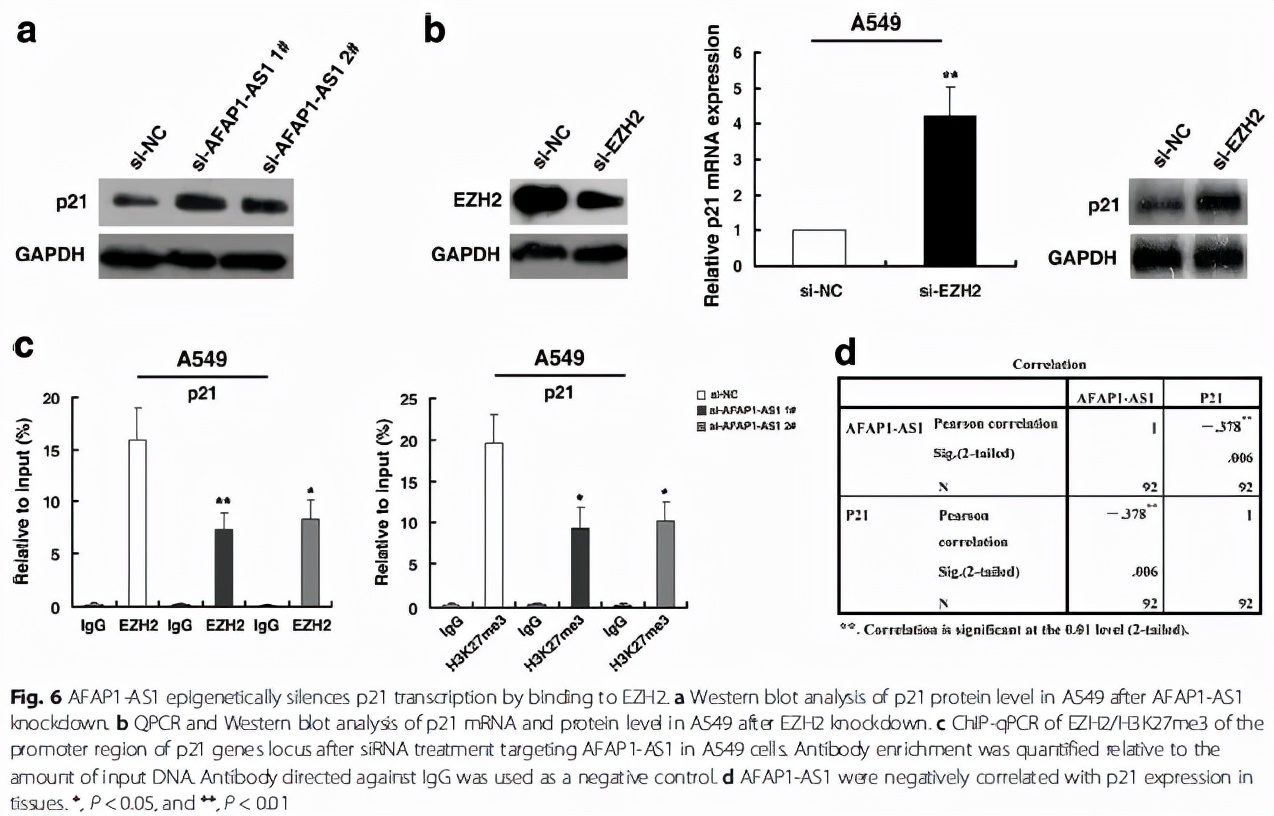
当然我们也可以参考其他一些lncRNA/EZH2/靶基因的文献,进一步增加我们的实验丰度,但是核心的(最低碳的)机制基本就是该文献中展现的这样。值得注意的是,一般来说,lncRNA并不会改变EZH2的整体表达,只是将EZH2招募到启动子区域;而对于H3K27me3的整体表达,则存在lncRNA的差异性,有的会上调,有的则并不改变。
关于lncRNA与组蛋白甲基化的技术总结
1. 关键的验证内容是lncRNA与EZH2的结合,以及lncRNA对EZH2, H3K27me3在靶基因启动子区域的富集的调控。
2. 虽然此文献中没有展示,但这里强烈建议还是要加上RNA pull down的结果与RIP结果一道作为lncRNA结合EZH2的进一步的验证。
3. 一般来说不需要再深入研究lncRNA与EZH2的作用机制。
4. 除了H3K27me3,还存在如H3K4me3,H3K9me3的修饰,如果你手头的lncRNA已经有了与EZH2的报道,不妨尝试其他几种修饰。
(二)
LncRNA与RNA结合蛋白(RNA bind protein, RBP)
本节关键词:mRNA稳定性
本节相关文献:Long Noncoding RNA MEG3 Induces Cholestatic Liver Injury by Interaction With PTBP1 to Facilitate Shp mRNA Decay,Hepatology,IF:14
接下来我们再看另一种lncRNA通过非ceRNA的机制调控基因表达的方式。RNA结合蛋白(RBP),顾名思义是一类可以与RNA结合的蛋白。RBP可以通过与mRNA结合,调控mRNA的剪切(splicing),稳定性(stability),翻译起始(translation initiation)等过程,从而在翻译阶段调控基因的表达。我们通过这篇2017年发表于Hepatology(14分)上的文章(Long Noncoding RNA MEG3 Induces Cholestatic Liver Injury by Interaction With PTBP1 to Facilitate Shp mRNA Decay),来了解一下经典的lncRNA+RBP的套路。同样,我们先看一张机制图来对这个机制有一个初步的理解。
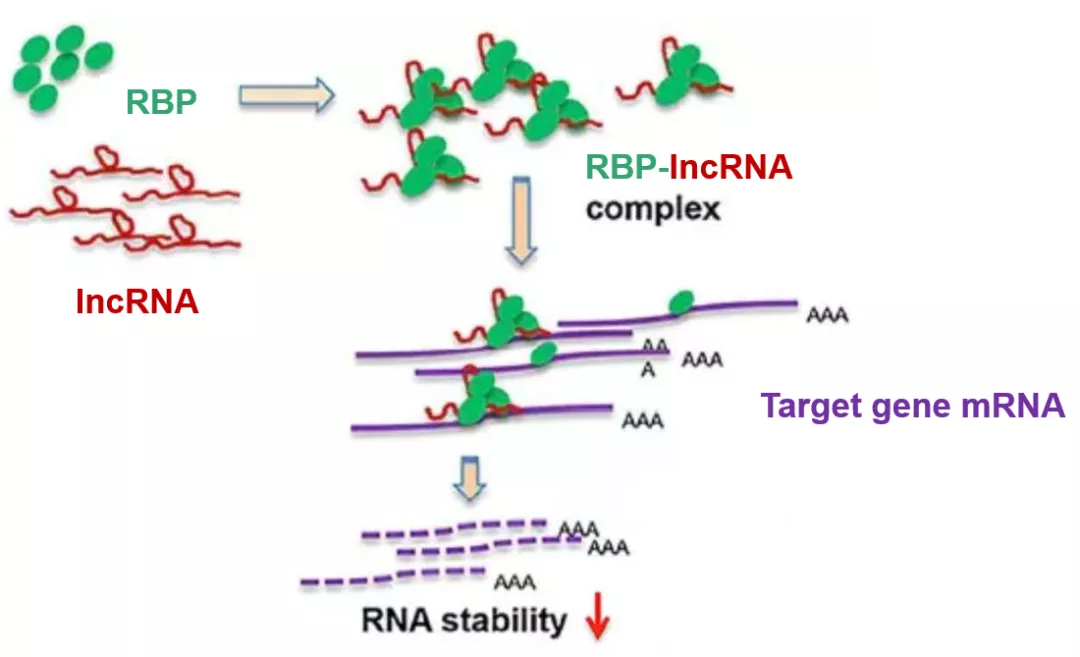
作者一上来就直奔主题,筛选和验证能够与lncRNA MEG3结合的RBP:通过有义链(sense)和作为阴性对照的反义链(anti-sense)的MEG3探针(Fig. 1A),进行RNA pull down后在SDS-PAGE胶上进行考马斯亮蓝染色(非特异的染蛋白质),通过对比anti-sense和sense链的差异条带(Fig. 1B,箭头所示),将该部分胶进行质谱分析,发现其中所包含的几十种蛋白中含有PTBP1(正文未展示,补充材料),接着再通过RNA pull down(Fig. 1C)以及RIP(Fig. 1D)实验进一步确认了MEG3与PTBP1的结合。
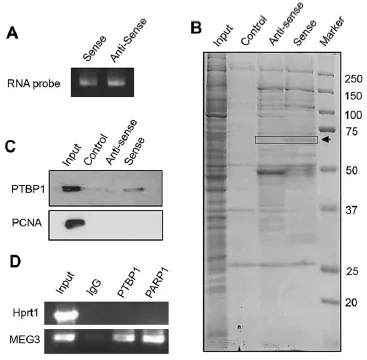

接下来,作者通过预测软件(RNAmap,starbase 2.0)找到了与PTBP1结合的mRNA SHP(Fig. 2A)。然后在三种细胞中通过RIP验证了SHP mRNA与PTBP1的结合,并且这种结合会受到MEG3过表达的促进(Fig. 2B)。发现没有,与ceRNA的竞争结合的机制相反,lncRNA在结合RBP后,并不会导致与靶基因mRNA结合的RBP减少,而是促进RBP与mRNA的结合。进一步地,通过RNA pull down实验,作者验证了PTBP1与SHP mRNA的哪一部分结合(CDS,3’UTR)(Fig. 2C)。最后,通过mRNA降解实验,作者验证了过表达MEG3和(或)PTBP1能够促进SHP mRNA的降解(Fig. 2D)。
至此,我们可以跟着下面所示的这篇文献的思路图,总结lncRNA/RBP/靶分子的研究套路,先通过RNA pull down/质谱筛选和确认与lncRNA结合的RBP分子,并使用RIP和RNA pull down进行验证;再通过预测找到与RBP结合下游靶分子mRNA,通过RIP,RNA pull down验证lncRNA是否影响RBP与mRNA的结合,最后通过mRNA降解实验验证lncRNA以及RBP对mRNA的表达的变化的影响。
小拓展1:RBP分子并不像miRNA或是EZH2一样,仅对下游mRNA或基因产生抑制。在上文分享的例子中,PTBP1是降解靶基因的mRNA的,但是也有文献报道PTBP1能够增加某些mRNA的稳定性(Long noncoding RNA ANCR inhibits the differentiation of mesenchymal stem cells toward definitive endoderm by facilitating the association of PTBP1 with ID2),或通过选择性剪切的方式调控mRNA(PTBP1-Mediated Alternative Splicing Regulates the Inflammatory Secretome and the Pro-tumorigenic Effects of Senescent Cells),这也使得RBP的设计套路更加灵活。
小拓展2:关于lncRNA到底是如何影响RBP与mRNA的结合,与上面的EZH2一样,一般也少有深入研究,诚如上述这篇14分的hepatology也只是在讨论里阐述了几种可能的机制(见下方截图),留下一句future studies would be necessary让人浮想联翩,想要深入探索的同学不妨朝这方面入手(慎重),想要在自己的讨论里吹吹水的同学也可以多作借鉴(推荐)。
关于lncRNA与RBP的技术总结
1. 关键的验证内容是lncRNA与RBP的结合,以及lncRNA对RBP与mRNA结合稳定性的调控
2. 一般来说不需要再深入研究lncRNA与RBP的机制
3. RBP存在功能多样性,可以正向,负向调控下游mRNA的稳定性
4. 如果没有做质谱的条件,也可以参考预测软件的结果找到lncRNA可能结合的RBP
好了,考虑到大家可能已经开始出现看文献时易发的头晕,恶心的症状,本期先为大家介绍两种lncRNA在离开miRNA后的机制研究方向:第一种是lncRNA通过调控H3K27me3组蛋白甲基化;第二种是lncRNA通过RBP调控mRNA的稳定性,觉得有点启发的同学可以在清醒后继续关注,在下一期中我们会为大家带来另外两种不同于ceRNA的机制。
