

TSA 放大技术如何提升检测信噪比?【TSA 检测外包】
 2025-09-25 11:45:59
2025-09-25 11:45:59
来源/作者:普拉特泽-生物医学整体课题外包平台
抗体非特异性:多克隆抗体易与无关蛋白交叉反应,或一抗浓度过高导致非特异性吸附;
酪胺活性失控:高浓度酪胺或过长反应时间,使活化中间体扩散至靶标外区域,与组织中酪氨酸残基非特异性结合;
抑制剂缺失:未有效阻断样本内源性过氧化物酶,其与 HRP 竞争底物,引发非特异性信号沉积。
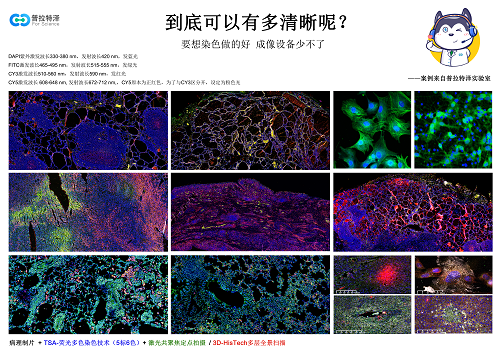
清洗不彻底:抗体孵育后残留的游离 HRP 二抗,会在后续反应中催化酪胺沉积,形成 “伪信号”;
抗原修复过度:过高温度或过强 pH 值的修复液,破坏组织蛋白结构,增加抗体非特异性结合位点;
孵育条件不当:室温长时间孵育加速酪胺扩散,或未摇匀导致反应不均,出现局部背景升高。

滤光片带宽过宽:成像时相邻荧光通道串色,如 Cy3 信号溢出至 FITC 通道,误判为背景;
样本本身干扰:肝脏、肾脏等组织含高浓度内源性过氧化物酶,或 FFPE 样本固定不佳导致蛋白交联异常,天然背景偏高。
抗体优先选 “单抗 + 验证款”:相比多克隆抗体,单克隆抗体特异性更高,可减少交叉反应。优先选择经 TSA 实验验证的抗体克隆,例如检测 PD-L1 时选用经过 IHC-TSA 联用验证的兔单抗,而非通用型抗体。同时需做梯度稀释测试:以传统方法最优浓度为基准,设置 2 倍、4 倍稀释梯度,例如 1:200、1:400、1:800,选择 “信号清晰且背景最低” 的浓度。
酪胺试剂选 “可控活性型”:优先选择含 “梯度浓度配比” 的试剂盒,如 TYR-xxxPlus 系列,可根据靶标丰度调整 1:50-1:400 的稀释比例 —— 低丰度靶标用 1:50 增强信号,高丰度靶标用 1:400 避免过放大。避免使用无浓度梯度的散装酪胺,易因浓度失控导致背景飙升。
配套试剂加 “特异性抑制剂”:针对高背景样本,选择含 “双重封闭体系” 的试剂盒:用 10% 山羊血清(与二抗同属种)封闭非特异性结合位点,再用 3% H₂O₂延长抑制内源性过氧化物酶(肝脏样本建议孵育 60 分钟)。
FFPE 样本:精准抗原修复:采用 “pH 梯度适配法”,上皮组织用 pH 6.0 柠檬酸盐缓冲液,间叶组织用 pH 9.0 Tris-EDTA 缓冲液,避免单一修复液导致的过修复或修复不足。修复后立即用冰 PBS 降温终止反应,减少蛋白变性引发的非特异性结合。
高酶活性样本:强化抑制:肝脏、肾脏样本在封闭步骤前,增加 “甲醇 - H₂O₂预处理”:3% H₂O₂与甲醇按 1:9 混合,室温孵育 30 分钟,比单独用 H₂O₂抑制效果提升 40%。
活细胞样本:避免毒性损伤:选择无毒性的 Alexa Fluor 系列酪胺探针,孵育时用含 2% BSA 的培养基替代普通缓冲液,减少细胞应激导致的自发荧光。
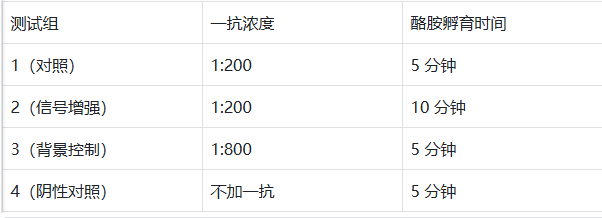
关键节点强化清洗:HRP 二抗孵育后、酪胺反应前,用含 0.1% Tween-20 的 PBS(PBT)在摇床上清洗 3 次,每次 10 分钟,比常规 PBS 清洗减少 60% 的游离 HRP 残留。酪胺反应终止后,立即用冰冷 PBT 快速冲洗 2 次,终止未反应的活化中间体。
多重染色加 “洗脱验证”:做多重 TSA 染色时,每轮染色后需验证抗体洗脱效果 —— 用洗脱液(如酸性甘氨酸缓冲液)处理后,加二抗直接孵育,若无信号则证明洗脱彻底,避免下一轮交叉污染。
滤光片选 “窄带宽款”:例如检测 Cy3 标记的信号时,选用带宽≤20nm 的滤光片,而非通用型宽带宽滤光片,可减少 90% 以上的串色干扰。若设备滤光片固定,可通过 “染料亮度匹配” 规避:低丰度靶标用高亮度染料(如 Alexa Fluor 647),高丰度靶标用低亮度染料(如 FITC),避免强信号溢出。
设置 “信号阈值” 定量筛选:用成像软件设定信噪比阈值(建议≥10:1),自动剔除低于阈值的背景信号。例如 Opal 染色中,将 Opal Intensity Level 控制在 5-20 之间,既保证信号强度,又避免过饱和。
阴性对照:不加一抗,仅做二抗 + 酪胺反应,排查试剂本身的非特异性沉积;
空白对照:不加酪胺试剂,仅做抗体孵育,验证抗体本身的荧光或显色信号;
单染对照:多重染色时,每个靶标单独染色,与多染结果对比,排查交叉反应导致的背景。
选型优先:单抗 + 可控活性酪胺 + 双重抑制剂,三者缺一不可;
优化核心:先做 “抗体 - 酪胺双梯度测试”,再定最终参数;
对照必做:阴性对照排除试剂干扰,单染对照验证特异性。

